
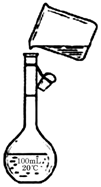
 为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):分析 除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,粗盐溶解后,加氯化钡除去SO42-,加NaOH除去Mg2+,加碳酸钠除去Ca2+及过量的氯化钡,过滤后,加盐酸,⑦为蒸发结晶,得到精盐,以此来解答.
解答 解:(1)第④步用到的试剂是Na2CO3,它的作用为除去粗盐溶液中的Ca2+及第②步中过量的Ba2+,
故答案为:Na2CO3;除去粗盐溶液中的Ca2+及第②步中过量的Ba2+;
(2)②③④所加试剂的顺序还可以为BaCl2、Na2CO3、NaOH或NaOH、BaCl2、Na2CO3,
故答案为:BaCl2、Na2CO3、NaOH或NaOH、BaCl2、Na2CO3;
(3)判断BaCl2已过量的方法是取少量②步后的上层清液于试管中,滴加少量BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量,
故答案为:取少量②步后的上层清液于试管中,滴加少量BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量;
(4)若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是先加盐酸会有部分沉淀溶解,从而影响制得精盐的纯度,
故答案为:先加盐酸会有部分沉淀溶解,从而影响制得精盐的纯度;
(5)第⑦步涉及的操作是蒸发、结晶、烘干,故答案为:蒸发、结晶、烘干;
(6)配制250mL0.2mol/L NaCl(精盐)溶液,由图可知未用玻璃棒引流、未采用250 mL容量瓶,故答案为:未用玻璃棒引流、未采用250 mL容量瓶.
点评 本题考查混合物分离提纯,为高频考点,把握粗盐提纯、物质的性质、发生的反应、混合物分离提纯为解答的关键,侧重分析与实验能力的考查,注意碳酸钠一定在氯化钡之后,题目难度不大.


科目:高中化学 来源: 题型:实验题
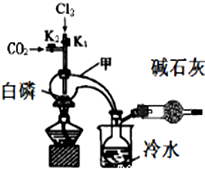 三氯化磷(PCl3)是合成药物的重要化工原料,可通过白磷和氯气化合得到.
三氯化磷(PCl3)是合成药物的重要化工原料,可通过白磷和氯气化合得到.| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 |
| 白磷 | 44.1 | 280.5 | 1.82 |
| PCl3 | -112 | 75.5 | 1.574 |
| POCl3 | 2 | 105.3 | 1.675 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 乙酸是食醋的主要成分,它具有以下化学性质:
乙酸是食醋的主要成分,它具有以下化学性质:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸钾、氢氧化钠 | B. | 氧化铜、二氧化锰 | C. | 氯化钾、二氧化锰 | D. | 硫酸铜、氢氧化钡 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤ | B. | ①②⑥ | C. | ②③⑥ | D. | 除④⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com