
【题目】在一定温度下,将等量的气体分别通入起始体积相同的密闭容器Ⅰ和Ⅱ中,使其发生反应,t0时容器Ⅰ中达到化学平衡,X,Y,Z的物质的量的变化如图所示.则下列有关推断正确的是 ( ) 
A.该反应的化学方程式为3X+2Y2Z
B.若两容器中均达到平衡时,两容器的体积V(Ⅰ)<V(Ⅱ),则容器Ⅱ达到平衡所需时间大于t0
C.若两容器中均达到平衡时,两容器中Z的物质的量分数相同,则Y为固态或液态
D.若达平衡后,对容器Ⅱ升高温度时其体积增大,说明Z发生的反应为吸热反应
【答案】BC
【解析】解:A、根据XYZ物质的量的变化图象分析,Z是反应物,XY是生成物,到平衡后,X生成1.8mol,Y生成1.2mol,Z反应1.8mol,则反应的化学方程式为:3Z3X+2Y,故A错误;B、反应的化学方程式为:3Z3X+2Y,若两容器中均达到平衡时,两容器的体积V(Ⅰ)<V(Ⅱ),则容器Ⅱ达到平衡时体积增大,压强减小的过程,达到平衡所需时间大于t0 , 故B正确;
C、若两容器中均达到平衡时,两容器中Z的物质的量分数相同,说明达到相同的平衡,不受压强的变化影响,所以反应前后气体体积应是不变的反应,所以X为固态或液态,故C正确;
D、若达平衡后,容器Ⅱ是恒压容器,升高温度时其体积增大,但不能说明平衡正向进行,Z发生的反应不一定为吸热反应,故D错误;
故选BC.
【考点精析】通过灵活运用化学平衡状态本质及特征,掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)即可以解答此题.


科目:高中化学 来源: 题型:
【题目】高氯酸三碳酰肼合镍{[Ni(CHZ)3](ClO4)2 }是一种新型的起爆药.
(1)Ni2+基态核外电子排布式为 .
(2)ClO4﹣的空间构型是;与ClO4﹣互为等电子体的一种分子为(填化学式).
(3)化学式中CHZ为碳酰肼,组成为CO(N2H3)2 , 碳酰肼中碳原子的杂化轨道类型为;1molCO(N2H3)2分子中含有σ键数目为 .
(4)高氯酸三碳酰肼合镍可由NiO、高氯酸及碳酰肼化合而成.NiO的晶胞结构如图所示,晶胞中含有的Ni2+数目为a,Ni2+的配位数为b,NiO晶体中每个镍离子距离最近的镍离子数目为c,则a:b:c= . 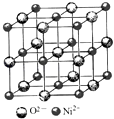
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.淀粉、纤维素、油脂都是高分子化合物
B.石油分馏和煤的干馏过程,都属于物理变化
C.甲烷、汽油、柴油、酒精都是碳氢化合物,都可作燃料
D.聚乙烯是无毒高分子材料,可用于制作食品包装袋
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.草酸可使酸性高锰酸钾溶液褪色,其离子方程式为:2MnO ![]() +5C2O
+5C2O ![]() +16H+=2Mn2++10CO2↑+8H2O
+16H+=2Mn2++10CO2↑+8H2O
B.向NH4Al(SO4)2溶液中加入过量的Ba(OH)2稀溶液:NH4++Al3++2SO ![]() +2Ba2++5OH﹣=2BaSO4↓+NH3?H2O+AlO
+2Ba2++5OH﹣=2BaSO4↓+NH3?H2O+AlO ![]() +2H2O
+2H2O
C.NaHSO3溶液与FeCl3反应的离子方程式:SO ![]() +2Fe3++H2O=SO
+2Fe3++H2O=SO ![]() +2Fe2++2H+
+2Fe2++2H+
D.NH4HCO3溶液中加入少量NaOH:NH4++OH﹣═NH3?H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,已知⑥为短周期元素,其单质为淡黄色固体,据表回答有关问题:
① | ② | ||||||
③ | ④ | ⑤ | ⑥ | ⑦ | |||
⑧ | ⑨ |
(1)⑥的元素符号 , 画出其原子结构示意图
(2)元素①③⑧最外层电子数都为 , 在周期表中在同一列,称为元素,③的金属性⑧的金属性(填>、=、<).
(3)②⑦⑨元素的性依次减弱(填金属性、非金属性),⑤的氧化物是氧化物(填酸性、碱性或两性),写出其与③的氧化物水化物反应的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H、C、N、F、Al、Ca、Ni、Cu是中学阶段常见的元素,回答下面几个小题
(1)基态Ni的外围电子排布式为
(2)比较C、N、Al的第一电离能(用元素符号表示)
(3)比较Cu、Al、C的最高价氧化物的沸点由高到低顺序为(用化学式表示)
(4)常温下某气态有机物由C、O、H三种元素组成,写出其中C的杂化方式
(5)Ni为电池中常见的材料,以Al和NiOOH为电极,NaOH为电解液组成电池,放电时NiOOH转化为Ni(OH)2写出电池的总反应
(6)Ca和F形成的某离子晶体结构如图所示,Ca2+的配位数为 . 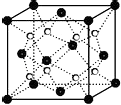
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌.以下是过氧化氢法生产亚氯酸钠的工艺流程图: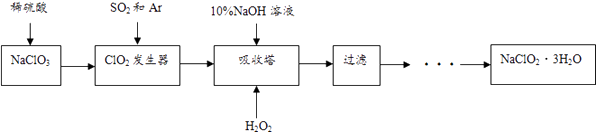
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO23H2O
②纯ClO2常温下为气体,易分解爆炸,一般用稀有气体或空气稀释到10%以下安全
(1)10%的NaOH溶液的密度为1.2g/cm3其物质的量浓度为 .
(2)在ClO2发生器中当1gSO2完全转化时,放出akJ热量,写出该热化学反应方程式鼓入Ar的作用是 .
(3)写出吸收塔内发生的化学反应方程式 . 吸收塔的温度不能超过40℃,其目的是 .
(4)从滤液中得到的NaClO23H2O粗晶体中往往含有杂质,要得到更纯的NaClO23H2O晶体方法是 .
(5)工业处理含NaClO2废水时,先向废水中加入适量NaOH,用惰性电极电解该废水,同时制得NaClO3 , 写出ClO2﹣在阳极放电时的电极反应方程式 .
(6)已知SO2和Ar的混合气体中,SO2的百分含量为5.6a%,当bL(标况下)该混合气体参加反应时,理论上需要的17%的H2O2的质量为g(结果必须化简).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关元素周期表的叙述中正确的是( )
A. 元素周期表有7个周期和18个族
B. 由短周期元素和长周期元素共同组成的族一定是主族
C. 从左向右数第13列是第ⅢB族
D. 元素周期表中0族元素的单质全部是气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com