
【题目】化学反应Fe(s)+CO2(g)![]() FeO(s)+CO(g),700℃时平衡常数为1.47,900℃时平衡常数为2.15。下列说法正确的是( )
FeO(s)+CO(g),700℃时平衡常数为1.47,900℃时平衡常数为2.15。下列说法正确的是( )
A.升高温度,该反应向逆向移动
B.该反应的化学平衡常数表达式为![]()
C.恒温恒容的条件下,向容器中再加入一定量铁粉,正反应速率加快
D.恒温恒容的条件下,向容器中再加入一定量CO2,再次达平衡后,c(CO)/c(CO2)值不变
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,在恒容密闭容器中发生反应2HI(g)+Cl2(g)![]() 2HCl(g) +I2(s)。下列事实不能说明该反应达到平衡状态的是
2HCl(g) +I2(s)。下列事实不能说明该反应达到平衡状态的是
A. 断裂1mol Cl-Cl键的同时形成2molH-Cl键
B. 容器内气体密度不再改变
C. 容器内气体颜色不再改变
D. 容器内气体压强不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以TiO2为催化剂的光热化学循环分解CO2反应为温室气体减排提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如下图所示。
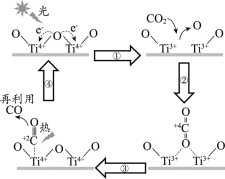
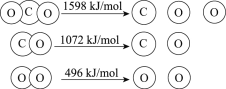
下列说法正确的是
A.过程①中钛氧键断裂会释放能量
B.该反应中,光能和热能转化为化学能
C.使用TiO2作催化剂可以降低反应的焓变,从而提高化学反应速率
D.CO2分解反应的热化学方程式为2CO2(g) =2CO(g) + O2(g) ΔH= + 30 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应mA(g)+nB(g)![]() pC(g)在密闭容器中进行,如图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是( )
pC(g)在密闭容器中进行,如图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是( )
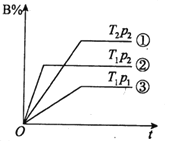
A.T1>T2 P1<P2 m+n<p 吸热反应
B.T1<T2 P1<P2 m+n>p 放热反应
C.T1<T2 P1>P2 m+n>p 放热反应
D.T1>T2 P1<P2 m+n>p 吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:H2(g)+![]() O2(g)=H2O(g) ΔH1
O2(g)=H2O(g) ΔH1
![]() N2(g)+O2(g)=NO2(g) ΔH2
N2(g)+O2(g)=NO2(g) ΔH2
![]() N2(g)+3/2H2(g)=NH3(g) ΔH3
N2(g)+3/2H2(g)=NH3(g) ΔH3
则反应2NH3(g)+![]() O2(g)=2NO2(g)+3H2O(g)的ΔH为( )
O2(g)=2NO2(g)+3H2O(g)的ΔH为( )
A. 2ΔH1+2ΔH2-2ΔH3B. ΔH1+ΔH2-ΔH3
C. 3ΔH1+2ΔH2+2ΔH3D. 3ΔH1+2ΔH2-2ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中短周期的一部分如图,关于X、Y、Z、W、Q说法正确的是
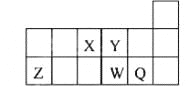
A.元素Y与元素Z的最高正化合价之和的数值等于9
B.原子半径的大小顺序为:W>Z>Y
C.离子半径的大小顺序为:W2->Y2->Z3+
D.W的气态氢化物的热稳定性和还原性均比Q强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.自然界中的物质绝大多数以混合物的形式存在,为了便于研究和利用,常需对混合物进行分离和提纯。下列A、B、C、D是中学常见的混合物分离或提纯的装置。
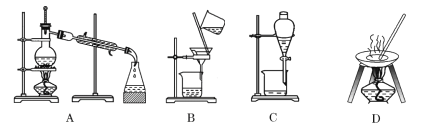
请根据混合物分离或提纯的原理,回答在下列实验中需要使用哪种装置。将A、B、C、D 填入适当的空格中。
(1)碳酸钙悬浊液中分离出碳酸钙__________;
(2)氯化钠溶液中分离出氯化钠___________;
(3)分离39%的乙醇溶液___________;
(4)分离溴的氯化钠溶液____________;
Ⅱ.利用“化学计量在实验中的应用”的相关知识进行填空
已知某饱和氯化钠溶液体积为VmL,溶液密度为d g/cm3,质量分数为w,物质的量浓度为c mol/L,溶液中含NaCl的质量为m g。
(1)用m、V表示溶液的物质的量浓度是_________
(2)用w、d表示溶液的物质的量浓度是_________
(3)用c、d表示溶液的质量分数是__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL0.5mol/L盐酸与50mL0.55mol/LNaOH溶液进行中和反应,通过测定反应过程中所放出的热量可计算中和热,下列说法正确的是
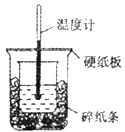
A.从实验装置上看,除了缺少环形玻璃搅拌棒外没有其他问题
B.大烧杯上如不盖硬纸板,测得的中和热数值会偏大
C.用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值会偏大
D.实验中改用60mL0.5mol/L盐酸跟50mL0.55mol/LNaOH溶液进行反应,与上实验相比,所放出的热量不相等,但是所求中和热相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌银电池的负极为锌,正极为氧化银,电解质是KOH,电池反应为Zn+Ag2O+H2O![]() Zn(OH)2+2Ag。以锌银电池为电源,电解硫酸镍溶液冶炼纯镍,装置如图所示。
Zn(OH)2+2Ag。以锌银电池为电源,电解硫酸镍溶液冶炼纯镍,装置如图所示。
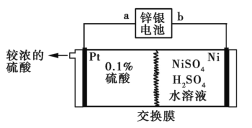
下列说法正确的是
A.装置中使用阳离子交换膜
B.锌银电池a极反应式为Ag2O+H2O+2e-![]() 2Ag+2OH-
2Ag+2OH-
C.镍极的主要反应为2H++2e-![]() H2↑
H2↑
D.若锌银电池溶解13 g锌,则镍极净增质量最多为5.9 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com