
【题目】可溶性钡盐有毒,医院中常用硫酸钡这种钡盐(俗称钡餐)作为内服造影剂。医院抢救钡离子中毒患者时除催吐外,还需要向中毒者胃中灌入硫酸钠溶液。已知:Ksp(BaCO3)=5.1×10-9;Ksp(BaSO4)=1.1×10-10。下列推断正确的是
A.BaCO3的溶度积常数表达式为 Ksp(BaCO3)= n(Ba2+)·n(CO32-)
B.可用2%~5%的Na2SO4溶液给钡离子中毒患者洗胃
C.若误服含c(Ba2+)=1.0×10-5 mol·L-1的溶液时,会引起钡离子中毒
D.不用碳酸钡作为内服造影剂,是因为Ksp(BaCO3)>Ksp(BaSO4)
【答案】B
【解析】
因胃酸可与CO32反应生成水和二氧化碳,使CO32浓度降低,从而使平衡BaCO3(s)Ba2+(aq)+CO32(aq) 向溶解方向移动,则BaCO3溶于胃酸,而硫酸钡不溶于酸,结合溶度积解答该题。
A.溶度积常数为离子浓度幂之积,BaCO3的溶度积常数表达式为Ksp(BaCO3)=c(Ba2+)·c(CO32-),故A错误;
B.根据公式c=![]() 得,2%~5%的Na2SO4溶液中Na2SO4的物质的量浓度为0.13mol/L~0.33mol/L,用0.13mol/L~0.33mol/L的Na2SO4溶液给钡离子中毒患者洗胃,反应后c(Ba2+)=
得,2%~5%的Na2SO4溶液中Na2SO4的物质的量浓度为0.13mol/L~0.33mol/L,用0.13mol/L~0.33mol/L的Na2SO4溶液给钡离子中毒患者洗胃,反应后c(Ba2+)=![]() mol/L~
mol/L~![]() mol/L,浓度很小,可起到解毒的作用,故B正确;
mol/L,浓度很小,可起到解毒的作用,故B正确;
C.c(Ba2+)=1.0×105 molL1的溶液钡离子浓度很小,不会引起钡离子中毒,故C错误;
D.因胃酸可与CO32反应生成水和二氧化碳,使CO32浓度降低,从而使平衡BaCO3(s)Ba2+(aq)+CO32(aq) 向溶解方向移动,使Ba2+浓度增大,Ba2+有毒,与Ksp大小无关,故D错误;
故答案选B。


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
【题目】在接触法制硫酸中,将SO2与空气按1∶3的体积比混合(空气中氮气与氧气的体积比为4∶1)后进入接触室,在一定条件下反应达到平衡后,气体总体积减少为原来的88%(体积均在相同情况下测定),求反应达到平衡时SO2的转化率_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度相同,向甲、乙两体积相同的密闭容器中,各通入2mol SO2和1 mol O2发生反应;
2SO2(g)+O2(g) ![]() 2SO3(g)达到平衡时,甲容器中SO2的转化率大于乙容器中SO2的转化率。下列判断正确的是 ( )
2SO3(g)达到平衡时,甲容器中SO2的转化率大于乙容器中SO2的转化率。下列判断正确的是 ( )
A.甲保持压强不变,乙保持体积不变
B.甲保持体积不变,乙保持压强不变
C.混合气体密度甲小于乙
D.混合气体的平均相对分子质量甲小于乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铍铜是广泛应用于制造高级弹性元件的良好合金。某科研小组从某废旧铍铜元件(含25%BeO、71%CuS、少量FeS和SiO2)中回收铍和铜两种金属的工艺流程如图:
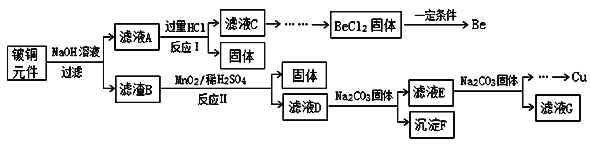
已知:I、铍、铝元素化学性质相似;
Ⅱ、常温下部分难溶物的溶度积常数如表:
难溶物 | Cu(OH)2 | Fe(OH)3 | Mn(OH)2 |
溶度积常数(Ksp) | 2.2×10-20 | 4.0×10-38 | 2.1×10-13 |
(1)滤液A的主要成分除NaOH、Na2BeO2外,还有___________(填化学式),写出反应I中Na2BeO2与过量盐酸反应的离子方程式:________。
(2)滤液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,最合理的实验步骤顺序为_______(填字母)
a.加入过量的氨水 b.通入过量的CO2 c.加入过量的NaOH d.加入适量的HCl e.洗涤 f.过滤
(3)MnO2能将金属硫化物中的硫元素氧化为硫单质,写出反应Ⅱ中CuS发生反应的化学方程式:___________。若用浓HNO3溶解金属硫化物,缺点是_______(任写一条)。
(4)滤液D中c(Cu2+)=2.2mol·L-1、c(Fe3+)=8.0×10-3mol·L-1、c(Mn2+)=0.01mol·L-1,逐滴加入Na2CO3溶液调节pH可将其转变成氢氧化物依次分离,首先沉淀的是_______(填离子符号);为使铜离子开始沉淀,常温下应调节溶液的pH大于______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述不正确的是( )
A.相同质量的CO和N2,所含原子个数相同
B.pH=1的H3PO4溶液中,含有0.1NA个H+
C.标准状况下,11.2L甲烷和乙烯混合物中含极性键数目为2NA
D.足量锌与一定量浓H2SO4反应,生成1 mol气体时转移的电子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,三硫代碳酸钠(Na2CS3)是玫瑰红色针状固体,与碳酸钠性质相近。在工农业生产中有广泛的用途。某小组设计实验探究三硫代碳酸钠的性质并测定其溶液的浓度。
实验一:探究Na2CS3的性质
(1)向Na2CS3溶液中滴入酚酞试液,溶液变红色。用离子方程式说明溶液呈碱性的原因_________。
(2)向Na2CS3溶液中滴加酸性KMnO4溶液,紫色褪去。该反应中被氧化的元素是__________。
实验二:测定Na2CS3溶液的浓度
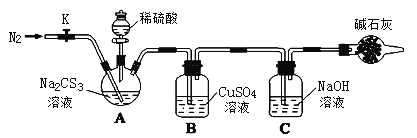
按如图所示连接好装置,取50.0mLNa2CS3溶液置于三颈瓶中,打开分液漏斗的活塞,滴入足量2.0mol/L稀H2SO4,关闭活塞。
已知:Na2CS3+ H2SO4=Na2SO4+ CS2+ H2S↑。CS2和H2S均有毒。CS2不溶于水,沸点46℃,密度1.26g/mL,与CO2某些性质相似,与NaOH作用生成Na2COS2和H2O。
(1)盛放碱石灰的仪器的名称是_______,碱石灰的主要成分是______(填化学式)。
(2)C中发生反应的离子方程式是____________。
(3)反应结束后打开活塞K,再缓慢通入N2一段时间,其目的是_________。
(4)为了计算Na2CS3溶液的浓度,对充分反应后B中混合物进行过滤、洗涤、干燥、称重,得8.4g 固体,则三颈瓶中Na2CS3的物质的量浓度为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,某溶液中由水电离产生的OH-的物质的量浓度为1×10-12mol/L,此溶液可能是( )
A.pH=12的KCN溶液B.pH=12的NaOH溶液C.0.01mol/LH2SO4D.0.02mol/LHCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如表:下列说法错误的是:( )
物质 | X | Y | Z |
初始浓度/ | 0.1 | 0.2 | 0 |
平衡浓度/ | 0.05 | 0.05 | 0.1 |
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y![]() 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.改变温度可以改变此反应的平衡常数
D.增压使平衡向生成Z的方向移动,平衡常数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、理象和结论均正确的是( )
选项 | 操作 | 现象 | 结论 |
A | 向某溶液中加入NaOH 溶液,并用湿润的红色石蕊试纸检验 | 试纸没有变蓝 | 原溶液中没有有NH4+ |
B | 向苏打和小苏打溶液中分别加入盐酸 | 均冒气泡 | 两者均能与盐酸反应 |
C | 向某溶液中滴加氯水后,再加KSCN溶液 | 溶液变红 | 原溶液中一定有Fe2+ |
D | 向某无色溶液中滴加BaCl2溶液 | 产生白色沉淀 | 该无色溶液中一定含有SO42- |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com