
【题目】温度相同,向甲、乙两体积相同的密闭容器中,各通入2mol SO2和1 mol O2发生反应;
2SO2(g)+O2(g) ![]() 2SO3(g)达到平衡时,甲容器中SO2的转化率大于乙容器中SO2的转化率。下列判断正确的是 ( )
2SO3(g)达到平衡时,甲容器中SO2的转化率大于乙容器中SO2的转化率。下列判断正确的是 ( )
A.甲保持压强不变,乙保持体积不变
B.甲保持体积不变,乙保持压强不变
C.混合气体密度甲小于乙
D.混合气体的平均相对分子质量甲小于乙
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源: 题型:
【题目】羰基硫(COS)与氢气或与水在催化剂作用下的反应如下:
Ⅰ.COS(g)+H2(g)![]() H2S(g)+CO(g) △H1=-17kJ/mol;
H2S(g)+CO(g) △H1=-17kJ/mol;
Ⅱ.COS(g)+H2O(g)![]() H2S(g)+CO2(g) △H2=-35kJ/mol。
H2S(g)+CO2(g) △H2=-35kJ/mol。
回答下列问题:
(1)两个反应在热力学上趋势均不大,其原因是:________________。
(2)反应CO(g)+H2O(g)![]() H2(g)+CO2(g)的△H=_______。
H2(g)+CO2(g)的△H=_______。
(3)羰基硫、氢气、水蒸气共混体系初始投料比不变,提高羰基硫与水蒸气反应的选择性的关键因素是______。
(4)在充有催化剂的恒压密闭容器中只进行反应Ⅰ![]() 设起始充入的n(H2):n(COS)=m,相同时间内测得COS转化率与m和温度(T)的关系如图所示:
设起始充入的n(H2):n(COS)=m,相同时间内测得COS转化率与m和温度(T)的关系如图所示:

①m1______m2(填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() 。
。
②温度高于T0,COS转化率减小的可能原因为:i有副应发生;ii______;iii______。
(5)在充有催化剂的恒压密闭容器中进行反应Ⅱ.COS(g)与H2O(g)投料比分别为1:3和1:1,反应物的总物质的量相同时,COS(g)的平衡转化率与温度的关系曲线如图所示:
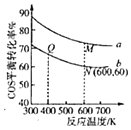
①M点对应的平衡常数______Q点![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() ;
;
②N点对应的平衡混合气中COS(g)物质的量分数为______;
③M点和Q点对应的平衡混合气体的总物质的量之比为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C60、金刚石和石墨的结构模型如图所示(石墨仅表示出其中的一层结构)。
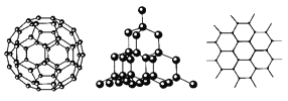
(1)C60、金刚石和石墨三者的关系互为________。
A.同分异构体 B.同素异形体
C.同系物 D.同位素
(2)固态时,C60属于________晶体(填“离子”、“原子”或“分子”),C60分子中含有双键的数目是________个。
(3)硅晶体的结构跟金刚石相似,1 mol硅晶体中含有硅硅单键的数目约是________NA个。二氧化硅的结构相当于在硅晶体结构中每个硅硅单键之间插入1个氧原子,二氧化硅的空间网状结构中,硅、氧原子形成的最小环上氧原子数目是________个。
(4)石墨层状结构中,平均每个正六边形占有的碳原子数是________个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸三碳酰肼合镍{[Ni(CHZ)3](ClO4)2}是一种新型的起爆药。
(1)Ni能与CO形成配合物Ni(CO)4,配体CO中提供孤电子对的是C原子,其理由可能是__;该配合物分子中σ键与π键数目之比为__。
(2)①ClO4-的空间构型是___。
②写出与ClO4-互为等电子体的一种分子和一种离子:__、__。(填化学式)
(3)化学式中CHZ为碳酰肼,其结构为![]() ,它是一种新型的环保锅炉水除氧剂。
,它是一种新型的环保锅炉水除氧剂。
①碳酰肼中氮元素的化合价为__,碳原子的杂化轨道类型为__。
②碳酰肼可以由碳酸二甲酯(![]() )和肼(N2H4)反应制得,有关的化学方程式为__。
)和肼(N2H4)反应制得,有关的化学方程式为__。
(4)高氯酸三碳酰肼合镍可由NiO、高氯酸及碳酰肼化合而成。
①比较次氯酸和高氯酸的酸性,并说明理由:___。
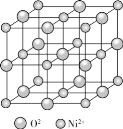
②如图为NiO晶胞,若晶胞中含有的Ni2+数目为a,Ni2+的配位数为b,NiO晶体中每个Ni2+距离最近的Ni2+数目为c,则a:b:c=__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】影响化学反应速率的因素很多,某课外兴趣小组用实验方法进行探究。
(1)取等物质的量浓度、等体积的H2O2溶液分别进行H2O2的分解实验,实验报告如下表所示(现象和结论略)。

①实验1、2研究的是__________对H2O2分解速率的影响。
②实验2、3的目的是_______________对H2O2分解速率的影响。
(2)查文献可知,Cu2+对H2O2分解也有催化作用,为比较Fe3+、Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:

①定性如图甲可通过观察_______,定性比较得出结论。有同学提出将CuSO4溶液改为CuCl2溶液更合理,其理由是_________。
②定量如图乙所示,实验时以收集到40 mL气体为准,忽略其他可能影响实验的因素,实验中需要测量的数据是__________。
(3)酸性高锰酸钾溶液和草酸溶液可发生反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,实验时发现开始反应速率较慢,溶液褪色不明显,但一段时间后突然褪色,反应速率明显加快。对此展开讨论:
①某同学认为KMnO4与H2C2O4的反应是______热反应,导致_______________;
②从影响化学反应速率的因素看,你认为还可能是________的影响。要证明你的猜想,实验方案是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铬铁矿[主要成份为Fe(CrO2)2,含有Al2O3、Fe2O3、SiO2等杂质]为主要原料生产重铬酸钠晶体(Na2Cr2O7·2H2O)的主要工艺流程如图:
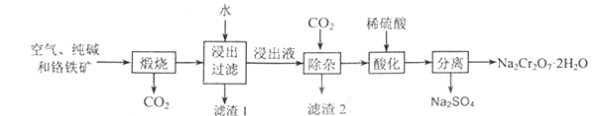
(1)煅烧过程中,铬铁矿中的Al2O3与纯碱反应的化学方程式为:____。
(2)滤渣1的成分为_____,滤渣2的成分为_____。
(3)该工艺中某种产物可以再利用,该物质的化学式为:_____。
(4)酸化时发生的反应为:2CrO42-+2H+![]() Cr2O72-+H2O,若1L酸化后所得溶液中含铬元素的质量为28.6g,CrO42-有
Cr2O72-+H2O,若1L酸化后所得溶液中含铬元素的质量为28.6g,CrO42-有![]() 转化为Cr2O72-。
转化为Cr2O72-。
①酸化时发生反应的平衡常数的表达式为K=_____。
②酸化后所得溶液中c(Cr2O72-)=____。
(3)根据有关国家标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7mol·L-1以下才能排放。含CrO42-的废水处理通常有以下两种方法。
①沉淀法:加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入可溶性硫酸盐处理多余的Ba2+。加入可溶性钡盐后的废水中Ba2+的浓度应不小于____mol·L-1,后续废水处理方能达到国家排放标准。
②还原法:CrO42-![]() Cr3+
Cr3+![]() Cr(OH)3。写出酸性条件下CrO42-与绿矾反应的离子方程式____。
Cr(OH)3。写出酸性条件下CrO42-与绿矾反应的离子方程式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是8种有机化合物的转换关系:
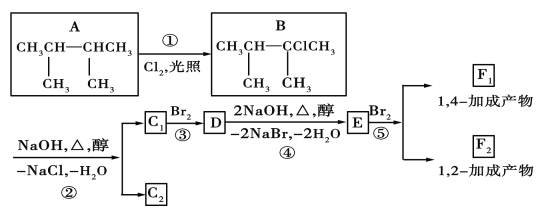
请回答下列问题:
(1)化合物E中含有的官能团的名称为___。
(2)上述框图中,①是___反应,③是___反应(填反应类型)。
(3)化合物E是重要的工业原料,写出由D生成E的化学方程式:___。
(4)C1的结构简式是___;F1的结构简式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可溶性钡盐有毒,医院中常用硫酸钡这种钡盐(俗称钡餐)作为内服造影剂。医院抢救钡离子中毒患者时除催吐外,还需要向中毒者胃中灌入硫酸钠溶液。已知:Ksp(BaCO3)=5.1×10-9;Ksp(BaSO4)=1.1×10-10。下列推断正确的是
A.BaCO3的溶度积常数表达式为 Ksp(BaCO3)= n(Ba2+)·n(CO32-)
B.可用2%~5%的Na2SO4溶液给钡离子中毒患者洗胃
C.若误服含c(Ba2+)=1.0×10-5 mol·L-1的溶液时,会引起钡离子中毒
D.不用碳酸钡作为内服造影剂,是因为Ksp(BaCO3)>Ksp(BaSO4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,向20mL 0.1 mol/L的CH3COOH溶液中逐滴滴加0.1 mol/L的NaOH溶液,滴入NaOH溶液的体积与溶液pH的变化如图所示。下列说法正确的是
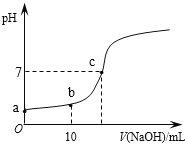
A. a点的pH=1
B. b点时,c (CH3COO—)=0.05mol/L
C. c点时,V(NaOH)=20mL
D. 反应过程中![]() 的值不断增大
的值不断增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com