
【题目】影响化学反应速率的因素很多,某课外兴趣小组用实验方法进行探究。
(1)取等物质的量浓度、等体积的H2O2溶液分别进行H2O2的分解实验,实验报告如下表所示(现象和结论略)。

①实验1、2研究的是__________对H2O2分解速率的影响。
②实验2、3的目的是_______________对H2O2分解速率的影响。
(2)查文献可知,Cu2+对H2O2分解也有催化作用,为比较Fe3+、Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:

①定性如图甲可通过观察_______,定性比较得出结论。有同学提出将CuSO4溶液改为CuCl2溶液更合理,其理由是_________。
②定量如图乙所示,实验时以收集到40 mL气体为准,忽略其他可能影响实验的因素,实验中需要测量的数据是__________。
(3)酸性高锰酸钾溶液和草酸溶液可发生反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,实验时发现开始反应速率较慢,溶液褪色不明显,但一段时间后突然褪色,反应速率明显加快。对此展开讨论:
①某同学认为KMnO4与H2C2O4的反应是______热反应,导致_______________;
②从影响化学反应速率的因素看,你认为还可能是________的影响。要证明你的猜想,实验方案是________________。
【答案】温度 不同催化剂(或比较FeCl3溶液和MnO2两种催化剂) 产生气泡的快慢 对照实验只有一条件不同(或避免由于阴离子不同造成的干扰)(或其他合理答案) 收集40 mL O2所需的时间 放 溶液温度升高,反应速率加快 催化剂(或生成的Mn2+催化作用) 取两组等浓度等体积的酸性KMnO4和草酸溶液实验,一组加入少量MnSO4固体,一组不加,比较反应速率
【解析】
影响化学反应速率的因素很多,实验1、2使用相同的催化剂,就可以探究温度对H2O2分解速率的影响.如果催化剂的催化效率高,则产生气泡快。在探究Fe3+和Cu2+对H2O2分解的催化效果时,必须保持其他的条件相同,所以将FeCl3改为Fe2(SO4)3更为合理,可以避免由于阴离子不同造成的干扰。催化效率越高,则一定时间内产生的气体越多;影响反应速率的因素除了浓度、温度外,催化剂也影响反应速率;根据反应方程式可知,反应产物中锰离子随着反应的进行,浓度变化较大,反应前加入硫酸锰,根据反应速率大小判断锰离子是否在该反应中起到催化作用。
(1)①实验1、2使用相同的催化剂,但温度不同,所以反应速率不同是由温度不同导致的,所以可以探究温度对H2O2分解速率的影响,故答案为:温度;
①试验2、3温度相同,使用不同的催化剂,故该实验比较FeCl3溶液和MnO2两种催化剂对H2O2分解速率影响的差异,故答案为:比较FeCl3溶液和MnO2两种催化剂对H2O2分解速率影响的差异;
(2)①定性比较Fe3+和Cu2+对H2O2分解的催化效果,可以通过观察产生气泡的快慢来比较,产生气泡快的,催化效果好;在探究Fe3+和Cu2+对H2O2分解的催化效果是,必须保持其他的条件相同,所以将FeCl3改为Fe2(SO4)3更为合理,可以避免由于阴离子不同造成的干扰,
故答案为:反应产生气泡的快慢;控制阴离子相同,排除阴离子的干扰;
②定量比较Fe3+和Cu2+对H2O2分解的催化效果,由图可知,可以通过测定一定时间内产生的气体(或测定产生一定体积的气体所需的时间)来比较。一定时间内产生的气体越多或产生一定体积的气体所需的时间越短,则催化效果越好,故答案为:收集40mL气体所需时间;
(3)①实验时发现开始反应速率较慢,溶液褪色不明显,但一段时间后突然褪色,反应速率明显加快,故该反应为放热反应,导致溶液温度升高,化学反应速率加快,故答案为:放;溶液温度升高,反应速率加快;
②对化学反应速率影响最快的是催化剂,故猜想还可能是催化剂的影响;反应方程式2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑中,浓度变化较大的为锰离子,所以选择的可以做催化剂的试剂应该含有锰离子,故答案为:催化剂(Mn2+的催化作用);用两组酸性高锰酸钾溶液和草酸溶液作对比实验,一组加入少量MnSO4固体,一组不加,看反应速率快慢。


科目:高中化学 来源: 题型:
【题目】在一定温度下,10mL0.40mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)![]()
![]() mol/(L·min)
mol/(L·min)
B.6~10min的平均反应速率:v(H2O2)<![]() mol/(L·min)
mol/(L·min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计了一个简单的实验(如图所示),以测定镁铝合金中铝的质量分数。可供选用的试剂有:浓H2SO4、浓硝酸、6 mol·l-1NaOH溶液。

请填写下列空白:
(1)有关实验操作:a、往试管中放入适量的铝合金样品;b、从分液漏斗往试管中加入过量的A溶液;c、检查装置的气密性;d、测定收集到的水的体积。
正确的操作顺序为_________________________________________。
(2)A溶液可选用________________________________________
(3)若实验中测得样品的质量为W g ,氢气的体积为a L(标准状况),则样品中Al的质量分数为_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示中学化学中常见物质的实验转化过程,部分物质和反应条件略去。
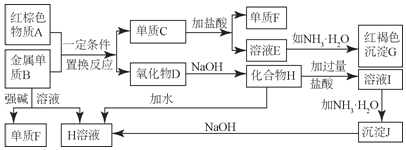
(1)写出F的化学式______;写出物质A的一种用途______;
(2)写出单质B与强碱溶液反应的离子方程式______,写出沉淀J生成H溶液的离子方程式______;
(3)溶液E中加入氨水时,先生成白色沉淀L,写出生成L的离子方程式______;
(4)溶液I中所含金属离子是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机制药工业中常用以下方法合成一种药物中间体(G):


(1)G的分子式是___。
(2)化合物A中含氧官能团的名称为___。
(3)由C→D的反应类型为___;化合物E的结构简式为___。
(4)写出B→C的反应的化学方程式:___。
(5)写出同时满足下列条件的B的一种同分异构体的结构简式:___。
①能与新制Cu(OH)2在加热条件下反应生成砖红色沉淀,水解产物之一能与FeCl3溶液发生显色反应;
②核磁共振氢谱为四组峰,峰面积比为1∶2∶4∶9;
③分子中含有氨基。
(6)已知:RCN![]() RCH2NH2,请写出以HOOCCH2CH2COOH和CH3CH2Cl为原料制备
RCH2NH2,请写出以HOOCCH2CH2COOH和CH3CH2Cl为原料制备![]() 的合成路线流程图___(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图___(无机试剂任用)。合成路线流程图示例如下:
CH3CH2OH![]() CH2
CH2![]() CH2
CH2![]() CH3CH2Cl
CH3CH2Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和铝是科技、生产、生活中应用最广泛的金属材料。

现有铁、铝的混合物进行如下实验:
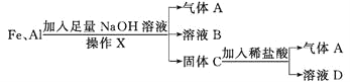
(1)操作X的名称是_____。
(2)气体A是_____。
(3)A与Cl2混合光照可能发生爆炸,生成_____(填化学式),A在该反应中作为_____(填“氧化剂”或“还原剂”)。
(4)溶液B中阴离子除OH-外还有_____,溶液D中存在的金属离子为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家设计二氧化碳熔盐捕获及电化学转化装置,其示意图如下:

下列说法不正确的是
A. b为电源的正极
B. ①②中,捕获CO2时碳元素的化合价发生了变化
C. a极的电极反应式为2C2O52 4e == 4CO2 + O2
D. 上述装置存在反应:CO2 ===== C + O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,恒容密闭容器内某一反应体系中M、N的物质的量随反应时间变化的曲线如右图所示,下列叙述正确的是( )

A. 该反应的化学方程式为2M![]() N
N
B. t1时N的浓度是M浓度的2倍
C. t2时正、逆反应速率相等,反应达到平衡状态
D. t3时正反应速率大于逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝及其化合物在生产生活中具有重要的作用。
(1)铝属于活泼金属却能在空气中稳定存在,原因是![]() 用化学用语及相关文字说明表达式为______
用化学用语及相关文字说明表达式为______
(2)下列实验能比较镁和铝的金属性强弱的是______![]() 填字母序号
填字母序号![]()
![]() 测定镁和铝的导电性强弱
测定镁和铝的导电性强弱
![]() 测定等物质的量浓度的
测定等物质的量浓度的![]() 和
和![]() 溶液的pH
溶液的pH
![]() 向
向![]() 和
和![]()
![]() 中加过量NaOH溶液
中加过量NaOH溶液
(3)冶炼金属铝时,用石墨做电极电解熔融______![]() 填化学式
填化学式![]() ,液态铝在______
,液态铝在______![]() 填“阴”或“阳”
填“阴”或“阳”![]() 极得到
极得到
(4)![]() 与
与![]() 在高温下反应可制得高温结构陶瓷氮化铝
在高温下反应可制得高温结构陶瓷氮化铝![]() ,且生成
,且生成![]() 。NaN3晶体中阴、阳离子个数比为______,写出反应化学方程式为______
。NaN3晶体中阴、阳离子个数比为______,写出反应化学方程式为______
(5)聚合铝![]() 是一种新型高效的无机高分子絮凝剂,广泛用于水的处理.用铝灰、铝土矿、铝渣等为原料
是一种新型高效的无机高分子絮凝剂,广泛用于水的处理.用铝灰、铝土矿、铝渣等为原料![]() 主要成分为Al、
主要成分为Al、![]() 可制取聚合铝.实验步骤如下:
可制取聚合铝.实验步骤如下:

①写出酸溶过程中发生的非氧化还原反应的离子方程式:______
②聚合铝![]() 的分子式为
的分子式为![]() ,聚合铝中
,聚合铝中![]() 与
与![]() 的比值对净水效果有很大影响,定义盐基度
的比值对净水效果有很大影响,定义盐基度![]() :
:![]() ,当
,当![]() 时,
时,![]() ______
______![]() 填入合适数字
填入合适数字![]()
③制取聚合铝的方法有多种,若将步骤I后的溶液pH直接调制![]() 时,将在过程④发生聚合而得到某种聚合铝
时,将在过程④发生聚合而得到某种聚合铝![]() ,写出生成该聚合铝的离子反应方程式是______
,写出生成该聚合铝的离子反应方程式是______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com