
【题目】一定温度下,恒容密闭容器内某一反应体系中M、N的物质的量随反应时间变化的曲线如右图所示,下列叙述正确的是( )

A. 该反应的化学方程式为2M![]() N
N
B. t1时N的浓度是M浓度的2倍
C. t2时正、逆反应速率相等,反应达到平衡状态
D. t3时正反应速率大于逆反应速率
科目:高中化学 来源: 题型:
【题目】水合肼(N2H4·H2O)是无色,具有强还原性的液体,易溶于水,沸点约为118℃,实验室可用如下图所示实验装置制取水合肼。

(1)仪器X的名称是:__________。
(2)制取N2H4·H2O反应中还有Na2CO3、NaCl生成。写出反应的化学方程式:__________。
(3)反应时应逐滴滴加NaClO溶液,且NaClO溶液不能过量,原因是__________。
(4)某实验小组用如下实验测定某溶液中N2H4·H2O的含量(g·L1):
步骤1:准确量取溶液25.00 mL,向其中加入过量的浓度为0.5000 mol·L-1的I2溶液20.00 mL、一定量的H2SO4和NaHCO3,充分反应;
步骤2:向步骤1反应后的溶液中滴加少量淀粉溶液,用0.5000 mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液16.00 mL。
测定过程中的反应如下:
N2H4·H2O+H2SO4+NaHCO3+I2-N2↑+CO2↑+Na2SO4+NaI+H2O(未配平)
2Na2S2O3+I2=Na2S4O6+2NaI
计算溶液中N2H4·H2O的含量(g·L1),写出计算过程_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】影响化学反应速率的因素很多,某课外兴趣小组用实验方法进行探究。
(1)取等物质的量浓度、等体积的H2O2溶液分别进行H2O2的分解实验,实验报告如下表所示(现象和结论略)。

①实验1、2研究的是__________对H2O2分解速率的影响。
②实验2、3的目的是_______________对H2O2分解速率的影响。
(2)查文献可知,Cu2+对H2O2分解也有催化作用,为比较Fe3+、Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:

①定性如图甲可通过观察_______,定性比较得出结论。有同学提出将CuSO4溶液改为CuCl2溶液更合理,其理由是_________。
②定量如图乙所示,实验时以收集到40 mL气体为准,忽略其他可能影响实验的因素,实验中需要测量的数据是__________。
(3)酸性高锰酸钾溶液和草酸溶液可发生反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,实验时发现开始反应速率较慢,溶液褪色不明显,但一段时间后突然褪色,反应速率明显加快。对此展开讨论:
①某同学认为KMnO4与H2C2O4的反应是______热反应,导致_______________;
②从影响化学反应速率的因素看,你认为还可能是________的影响。要证明你的猜想,实验方案是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偏二甲肼![]() 为
为![]() 价
价![]() 与
与![]() 是常用的火箭推进剂,发生的化学反应如下:
是常用的火箭推进剂,发生的化学反应如下:![]()
![]() ,下列说法不正确的是
,下列说法不正确的是 ![]()
![]()
A.该反应在任何情况下都能自发进行
B.![]() 含有
含有![]() 共价键
共价键
C.反应中,氧化产物为![]() ,还原产物为
,还原产物为![]()
D.反应中,生成![]() 时,转移
时,转移![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫是形成酸雨的罪魁祸首之一,含硫煤燃烧的尾气处理一直是化学研究的重要课题。某工厂设计了新的治污方法,该工艺流程如图所示,下列叙述不正确的是( )
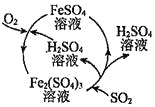
A.该过程中可得到化工产品![]()
B.该工艺流程中![]() 可以循环利用
可以循环利用
C.若处理含![]() 的尾气,理论上需要通入相同条件下的空气约
的尾气,理论上需要通入相同条件下的空气约![]()
D.可用澄清石灰水检验最终排出的气体是否含有二氧化硫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的值,N表示粒子数。下列叙述正确的是( )
A. 在标准状况下2.24LCCl4中含有的C—Cl键数为0.4NA
B. 将1mol Cl2通入水中,则N(HClO)+N(Cl)+N(ClO)=2NA
C. 将CO2通过Na2O2使其质量增加a g时,反应转移的电子数为aNA/14
D. 3.0g含甲醛(HCHO)的冰醋酸中含有的原子总数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟及其化合物用途非常广泛。回答下列问题:
(1)基态锑(Sb)原子价电子排布的轨道式为____。[H2F]+[SbF6]—(氟酸锑)是一种超强酸,存在[H2F]+,该离子的空间构型为______,依次写出一种与[H2F]+具有相同空间构型和键合形式的分子和阴离子分别是_______、_________。
(2)硼酸(H3BO3)和四氟硼酸铵(NH4BF4)都有着重要的化工用途。
①H3BO3和NH4BF4涉及的四种元素中第二周期元素的第一电离能由大到小的顺序_____(填元素符号)。
②H3BO3本身不能电离出H+,在水中易结合一个OH﹣生成[B(OH)4]﹣,而体现弱酸性。[B(OH)4]﹣中B原子的杂化类型为_____。
③NH4BF4(四氟硼酸铵)可用作铝或铜焊接助熔剂、能腐蚀玻璃等。四氟硼酸铵中存在_______(填序号):
A 离子键 B σ键 C π键 D 配位键 E 范德华力
(3)某砷镍合金的晶胞如图所示,设阿伏加德罗常数的值为![]() ,该晶体的密度ρ_________g·cm-3。
,该晶体的密度ρ_________g·cm-3。
 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应A2 + 3B2(?)![]() 2AB3(g)中,AB3的百分含量(w)与温度和压强的关系如图所示。下列说法正确的是( )
2AB3(g)中,AB3的百分含量(w)与温度和压强的关系如图所示。下列说法正确的是( )
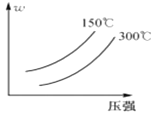
A.该反应为吸热反应
B.反应物B2为气体
C.升高温度,逆反应速率减慢
D.增大压强,A2转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表1是元素周期表的一部分:
氧 | X |
Y | Z |
![]() 时,用浓度为
时,用浓度为![]() 的NaOH溶液分别滴定
的NaOH溶液分别滴定![]() 浓度均为
浓度均为![]() 的两种酸HX、
的两种酸HX、![]() 忽略体积变化
忽略体积变化![]() ,实验数据如表
,实验数据如表
数据编号 | 滴入NaOH溶液的体积 | 溶液pH | |
HX | HZ | ||
① | 0 | 3 | 1 |
② | 20.00 | a | 7 |
下列判断正确的是
A.表格中![]()
B.HX和HZ等体积混合后![]()
C.Y和Z两元素的简单氢化物受热分解,前者分解温度高
D.![]()
![]()
![]() 的水溶液中:
的水溶液中:![]()
![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com