
【题目】水合肼(N2H4·H2O)是无色,具有强还原性的液体,易溶于水,沸点约为118℃,实验室可用如下图所示实验装置制取水合肼。

(1)仪器X的名称是:__________。
(2)制取N2H4·H2O反应中还有Na2CO3、NaCl生成。写出反应的化学方程式:__________。
(3)反应时应逐滴滴加NaClO溶液,且NaClO溶液不能过量,原因是__________。
(4)某实验小组用如下实验测定某溶液中N2H4·H2O的含量(g·L1):
步骤1:准确量取溶液25.00 mL,向其中加入过量的浓度为0.5000 mol·L-1的I2溶液20.00 mL、一定量的H2SO4和NaHCO3,充分反应;
步骤2:向步骤1反应后的溶液中滴加少量淀粉溶液,用0.5000 mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液16.00 mL。
测定过程中的反应如下:
N2H4·H2O+H2SO4+NaHCO3+I2-N2↑+CO2↑+Na2SO4+NaI+H2O(未配平)
2Na2S2O3+I2=Na2S4O6+2NaI
计算溶液中N2H4·H2O的含量(g·L1),写出计算过程_______________。
【答案】冷凝管 CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCl 防止生成的N2H4·H2O被过量的NaClO氧化 6 g·L1
【解析】
(1)根据装置图确定装置的名称;
(2)根据装置图可知,NaClO与NaOH、CO(NH2)2反应,生成N2H4·H2O、Na2CO3和NaCl;
(3)水合肼是无色,具有强还原性的液体,易被NaClO氧化;
(4)配平反应N2H4·H2O+H2SO4+6NaHCO3+2I2=N2↑+6CO2↑+Na2SO4+4NaI+7H2O,有题干可知,加入的I2溶液中n(I2)=0.5000mol/L×20.00×10-3L=0.01mol,过量的I2溶液用Na2S2O3溶液滴定,n(Na2S2O3)= 0.5000mol/L×16.00×10-3L=0.008mol,可知过量的n(I2)= 0.004mol,消耗的I2为0.006mol,进一步计算25ml溶液中N2H4·H2O的质量,最后换算为1L溶液中N2H4·H2O的质量。
(1)由装置图可知,仪器X为冷凝管;
(2)根据装置图可知,NaClO与NaOH、CO(NH2)2反应,生成N2H4·H2O、Na2CO3和NaCl,反应方程式为:CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCl;
(3)水合肼是无色,具有强还原性的液体,易被NaClO氧化,因此反应时应逐滴滴加NaClO溶液,且NaClO溶液不能过量,防止生成的N2H4·H2O被过量的NaClO氧化;
(4)配平反应N2H4·H2O+H2SO4+6NaHCO3+2I2=N2↑+6CO2↑+Na2SO4+4NaI+7H2O,有题干可知,加入的I2溶液中n(I2)=0.5000mol/L×20.00×10-3L=0.01mol,过量的I2溶液用Na2S2O3溶液滴定,n(Na2S2O3)= 0.5000mol/L×16.00×10-3L=0.008mol,可知过量的n(I2)=0.004mol,消耗的I2为0.006mol,根据方程式计量数之间的关系可知25.00 ml溶液中含N2H4·H2O的物质的量为0.003mol,其质量为0.003mol×50g/mol=0.15g,那么1L溶液中含N2H4·H2O的质量为6g,因此溶液中N2H4·H2O的含量为6g/L。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下表所示实验,现象和结论均正确的是( )
选项 | 实验 | 现象 | 结论 |
A | 向浓度均为0.lmol·L-1NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
B | 常温下,测定等物质的量浓度的Na2CO3和Na2SO3溶液的pH值 | 前者的 pH值比后者的大 | 非金属性:S>C |
C | 向某溶液中滴加足量盐酸 | 溶液中出现了气泡和淡黄色浑浊 | 溶液中含有S2-和 SO32- |
D | 向FeCl3和KSCN混合溶液中,加入少量KCl的固体 | 溶液颜色变浅 | FeCl3 +KSCN |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,10mL0.40mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)![]()
![]() mol/(L·min)
mol/(L·min)
B.6~10min的平均反应速率:v(H2O2)<![]() mol/(L·min)
mol/(L·min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物的转化过程如图所示。下列分析合理的是

A.催化剂 a 表面发生了极性共价键的断裂和形成
B.N2 与 H2 反应生成 NH3 的原子利用率为 100%
C.催化剂 a、b 能提高反应的平衡转化率
D.在催化剂 b 表面 2.24 L NH3 反应生成 NO 转移电子数目为 0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年10月1日是中华人民共和国成立70周年,国庆期间对大量盆栽鲜花施用了S-诱抗素制剂以保证鲜花盛开,利用下图所示的有机物X可生产S﹣诱抗素Y.下列说法不正确的是( )

A.1mol Y与1mol Br2反应的产物有4种
B.1mol Y与足量NaOH溶液反应,最多消耗3mol NaOH
C.1mol X最多能加成7mol H2
D.X可以发生氧化、取代、酯化、加聚、缩聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属的说法正确的是
A. 铝箔在空气中受热可以熔化且会发生剧烈燃烧
B. ![]() 在空气中燃烧,发出黄色火焰,生成白色固体
在空气中燃烧,发出黄色火焰,生成白色固体
C. 铁与水蒸气反应的产物是黑色的![]()
D. 铝制餐具不宜用来盛装酸性、碱性较强的食物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计了一个简单的实验(如图所示),以测定镁铝合金中铝的质量分数。可供选用的试剂有:浓H2SO4、浓硝酸、6 mol·l-1NaOH溶液。

请填写下列空白:
(1)有关实验操作:a、往试管中放入适量的铝合金样品;b、从分液漏斗往试管中加入过量的A溶液;c、检查装置的气密性;d、测定收集到的水的体积。
正确的操作顺序为_________________________________________。
(2)A溶液可选用________________________________________
(3)若实验中测得样品的质量为W g ,氢气的体积为a L(标准状况),则样品中Al的质量分数为_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示中学化学中常见物质的实验转化过程,部分物质和反应条件略去。
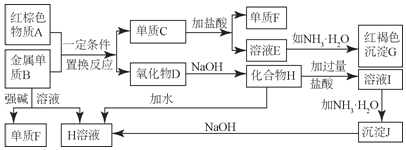
(1)写出F的化学式______;写出物质A的一种用途______;
(2)写出单质B与强碱溶液反应的离子方程式______,写出沉淀J生成H溶液的离子方程式______;
(3)溶液E中加入氨水时,先生成白色沉淀L,写出生成L的离子方程式______;
(4)溶液I中所含金属离子是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,恒容密闭容器内某一反应体系中M、N的物质的量随反应时间变化的曲线如右图所示,下列叙述正确的是( )

A. 该反应的化学方程式为2M![]() N
N
B. t1时N的浓度是M浓度的2倍
C. t2时正、逆反应速率相等,反应达到平衡状态
D. t3时正反应速率大于逆反应速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com