
【题目】下列关于金属的说法正确的是
A. 铝箔在空气中受热可以熔化且会发生剧烈燃烧
B. ![]() 在空气中燃烧,发出黄色火焰,生成白色固体
在空气中燃烧,发出黄色火焰,生成白色固体
C. 铁与水蒸气反应的产物是黑色的![]()
D. 铝制餐具不宜用来盛装酸性、碱性较强的食物
 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的有几句![]()
①3He、![]() 的化学性质基本相同;
的化学性质基本相同;
②3He、![]() 具有相同的中子数;
具有相同的中子数;
③3He核聚变是化学变化;
④3He液化是物理变化;
⑤3He、![]() 形成的单质中均含有非极性键;
形成的单质中均含有非极性键;
⑥3He、![]() 分别组成的气体单质,在相同条件下密度之比为3:4;
分别组成的气体单质,在相同条件下密度之比为3:4;
⑦由H原子形成![]() 键要吸收热量;
键要吸收热量;
⑧化学变化中的能量变化的大小与反应物的质量多少无关;
⑨在稀溶液中,强酸与强碱发生中和反应生成![]() 时所释放的热量称为中和热;
时所释放的热量称为中和热;
⑩锌锰干电池碳棒是负极,锌片是正极。
A.2B.3C.4D.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下述转化关系,回答问题:

已知:①+CH3Br![]() CH3+HBr;
CH3+HBr;
②C物质苯环上一卤代物只有两种。
(1)写出B物质的名称__________;D物质的结构简式________。
(2)写出反应②的类型________;反应⑤的条件________。
(3)写出反应⑥的化学方程式:________________________________。
(4)写出D+E反应的化学方程式:_______________。
(5)反应②还有可能生成一种C16H18的有机物,其苯环上一卤代物也只有两种,写出它的结构简式:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据信息书写相关反应方程式:
(1)磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。回收废旧磷酸亚铁锂电池正极片[含Al、炭黑、LiFePO4(难溶于水和碱)]中各物质的流程如下图所示:
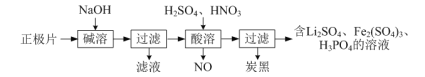
①写出“碱溶”时的离子方程式:________。
②写出“酸溶”时的化学方程式:________。
③LiFePO4可由Fe2O3、碳粉、LiH2PO4在480℃~900℃时混合共热制得,反应中还有CO生成,写出该反应的化学方程式:________。
(2)羟基自由基(电子式为![]() ,本题用·OH表示)有较强的氧化性,常用于污染物的治理。
,本题用·OH表示)有较强的氧化性,常用于污染物的治理。
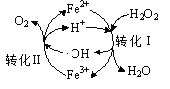
①pH=3时,Fe2+可循环催化H2O2的分解,过程中会产生·OH 中间体,转化过程如右图所示。写出转化Ⅱ的离子方程式:________。
②写出酸性条件下,·OH将水中的乙醛氧化成CO2和H2O的离子方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合肼(N2H4·H2O)是无色,具有强还原性的液体,易溶于水,沸点约为118℃,实验室可用如下图所示实验装置制取水合肼。

(1)仪器X的名称是:__________。
(2)制取N2H4·H2O反应中还有Na2CO3、NaCl生成。写出反应的化学方程式:__________。
(3)反应时应逐滴滴加NaClO溶液,且NaClO溶液不能过量,原因是__________。
(4)某实验小组用如下实验测定某溶液中N2H4·H2O的含量(g·L1):
步骤1:准确量取溶液25.00 mL,向其中加入过量的浓度为0.5000 mol·L-1的I2溶液20.00 mL、一定量的H2SO4和NaHCO3,充分反应;
步骤2:向步骤1反应后的溶液中滴加少量淀粉溶液,用0.5000 mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液16.00 mL。
测定过程中的反应如下:
N2H4·H2O+H2SO4+NaHCO3+I2-N2↑+CO2↑+Na2SO4+NaI+H2O(未配平)
2Na2S2O3+I2=Na2S4O6+2NaI
计算溶液中N2H4·H2O的含量(g·L1),写出计算过程_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某蓄电池放电、充电时的反应为:Fe+Ni2O3+3H2O![]() Fe(OH)2+2Ni(OH)2 下列推断中正确的是( )
Fe(OH)2+2Ni(OH)2 下列推断中正确的是( )
放电时,Fe为正极,Ni2O3为负极
②充电时,阴极上的电极反应式是:Fe(OH)2+2e-===Fe+2OH-
③充电时,Ni(OH)2为阳极
④该蓄电池的电极必须是浸在某种碱性电解质溶液中
A.①②③ B.②③④ C.①②④ D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化工生产中常用MnS作沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s)![]() CuS(s)+Mn2+(aq)下列有关叙述中正确的是( )
CuS(s)+Mn2+(aq)下列有关叙述中正确的是( )
①MnS的Ksp大于CuS的Ksp ②达到平衡时c(Mn2+)=c(Cu2+) ③溶液中加入少量Na2S固体后,溶液中c(Cu2+)、c(Mn2+)保持不变 ④该反应平衡常数K=
A. ①④ B. ②③
C. ①②③ D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某![]() 样品中含有
样品中含有![]() 和
和![]() 杂质,现欲制取纯净的
杂质,现欲制取纯净的![]() ,某同学设计如图的实验方案。请回答下列问题:
,某同学设计如图的实验方案。请回答下列问题:

(1)操作Ⅰ的名称是______,在该操作中用到的玻璃仪器除了有烧杯、玻璃棒,还有______
(2)沉淀A的成分是______![]() 填化学式
填化学式![]() ,写出第③步反应中铝元素转化的离子方程式______
,写出第③步反应中铝元素转化的离子方程式______
(3)写出证明滤液B中![]() 已沉淀完全的实验方法______
已沉淀完全的实验方法______
(4)不改变上述流程图的结构,将“①过量盐酸”“②过量NaOH”交换位置,则“③过量![]() ”应改为_____,写出此方案下生成沉淀B的离子方程式______
”应改为_____,写出此方案下生成沉淀B的离子方程式______
(5)为了得到更加纯净的![]() ,过滤后需要进行操作步骤是______
,过滤后需要进行操作步骤是______
(6)写出工业由氧化铝冶炼铝的化学方程式______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的值,N表示粒子数。下列叙述正确的是( )
A. 在标准状况下2.24LCCl4中含有的C—Cl键数为0.4NA
B. 将1mol Cl2通入水中,则N(HClO)+N(Cl)+N(ClO)=2NA
C. 将CO2通过Na2O2使其质量增加a g时,反应转移的电子数为aNA/14
D. 3.0g含甲醛(HCHO)的冰醋酸中含有的原子总数为0.4NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com