
����Ŀ��ijͬѧ�����һ����ʵ�飨��ͼ��ʾ�����Բⶨþ���Ͻ������������������ɹ�ѡ�õ��Լ��У�ŨH2SO4��Ũ���ᡢ6 mol��l-1NaOH��Һ��

����д���пհף�
��1���й�ʵ�������a�����Թ��з������������Ͻ���Ʒ��b���ӷ�Һ©�����Թ��м��������A��Һ��c�����װ�õ������ԣ�d���ⶨ�ռ�����ˮ�������
��ȷ�IJ���˳��Ϊ_________________________________________��
��2��A��Һ��ѡ��________________________________________
��3����ʵ���в����Ʒ������ΪW g �����������Ϊa L����״����������Ʒ��Al����������Ϊ_______________________________________��
���𰸡�cabd 6mol��l-1NaOH��Һ 9a/11.2w��100%
��������
����ˮ���ռ�����,ʵ����ͨ���ⶨ�������������,���ݼ���ȷ���Ͻ���Al����������,
(1)�ռ���������,����ҩƷǰ�ȼ���װ�õ�������,Ȼ����Ƚ����Ͻ�,�ټ�������������Һ,�ⶨ�ռ�����ˮ�����ȷ�����������������
(2)����ˮ���ռ�����,ʵ����ͨ���ⶨ���������������
(3)���������������������Ͻ���Al������,��������Ͻ���Al������������
����ˮ���ռ�����,ʵ����ͨ���ⶨ�������������,���ݼ���ȷ���Ͻ���Al����������,
(1)�ռ���������,����ҩƷǰ�ȼ���װ�õ�������,Ȼ����Ƚ����Ͻ�,�ټ�������������Һ,�ⶨ�ռ�����ˮ�����ȷ���������������,����ȷ�IJ���˳��Ϊcabd,
����:cabd��
(2)����ˮ���ռ�����,ʵ����ͨ���ⶨ�������������,��A���Լ�Ϊ6mol��l-1NaOH��Һ��
����: 6mol��l-1NaOH��Һ��
(3)ʵ���в����Ʒ������ΪWg,���������ΪaL(��״��),��:
2Al+2NaOH+2H2O�T2NaAlO2+3H2��
54g 3��22.4
m(Al) aL
����m(Al)=54��a/3��22.4=18a/22.4g���ʺϽ���Al����������=18a/22.4w��100%=9a/11.2w��100%��
����: 9a/11.2w��100%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ�ת���ڸ�����������ʵ�ֵ���
A.Al2O3![]() AlCl3(aq)
AlCl3(aq) ![]() ��ˮAlCl3B.Fe
��ˮAlCl3B.Fe![]() Fe2O3
Fe2O3![]() Fe(OH)3
Fe(OH)3
C.NH4Cl![]() NH3
NH3![]() NOD.ϡ����
NOD.ϡ����![]() Cl2
Cl2![]() Ca(ClO)2
Ca(ClO)2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�ⶨijѪҺ��Ʒ�и����ӵĺ�������ȡ����Ʒ2.00mL������ˮϡ�ͺ������м������������(NH4)2C2O4���壬��Ӧ����CaC2O4��������������ϡ���ᴦ����H2C2O4������1.000��10-4molL-1����KMnO4����Һ�ζ��������յ�ʱ��ȥ20.00mL��Һ��������˵���д�����ǣ� ��
A.������KMnO4(aq)�ζ�H2C2O4(aq)�����ӷ���ʽΪ��2MnO4-+5H2C2O4+6H+=2Mn2++10CO2��+8H2O
B.KMnO4����ҺӦ�ü�ʽ�ζ���ʢװ
C.�ζ��յ�ʱ������Ϊ�����1�α�KMnO4(aq)ʹ��ƿ����Һ����ɫ��Ϊdz��ɫ����Լ������ڲ���ɫ
D.���������Ʒ�и�����Ũ��Ϊ1.000��10-4gmL-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮ���£�N2H4��H2O������ɫ������ǿ��ԭ�Ե�Һ�壬������ˮ���е�ԼΪ118�棬ʵ���ҿ�������ͼ��ʾʵ��װ����ȡˮ���¡�

(1)����X�������ǣ�__________��
(2)��ȡN2H4��H2O��Ӧ�л���Na2CO3��NaCl���ɡ�д����Ӧ�Ļ�ѧ����ʽ��__________��
(3)��ӦʱӦ��εμ�NaClO��Һ����NaClO��Һ���ܹ�����ԭ����__________��
(4)ijʵ��С��������ʵ��ⶨij��Һ��N2H4��H2O�ĺ�����g��L1����
����1��ȷ��ȡ��Һ25.00 mL�������м��������Ũ��Ϊ0.5000 mol��L��1��I2��Һ20.00 mL��һ������H2SO4��NaHCO3����ַ�Ӧ��
����2������1��Ӧ�����Һ�еμ�����������Һ����0.5000 mol��L��1Na2S2O3��Һ�ζ����յ㣬����Na2S2O3��Һ16.00 mL��
�ⶨ�����еķ�Ӧ���£�
N2H4��H2O��H2SO4��NaHCO3��I2��N2����CO2����Na2SO4��NaI��H2O��δ��ƽ��
2Na2S2O3��I2=Na2S4O6��2NaI
������Һ��N2H4��H2O�ĺ�����g��L1����д���������_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڣ�Fe3O4���dz�������ϵ���ϡ�һ����ȡ���ڵ�ʵ��������ͼ��ʾ��

��ȡ���ڵķ�Ӧԭ���ɱ�ʾΪ��![]()
��1������FeSO4��Һʱ�������Լ�ƿ�м������ۣ���Ŀ����______________________________��
��2�����백ˮ��pHʱ��������Ӧ�����ӷ���ʽ_______________________________________��
��3��Fe(OH)2�ڿ���������ΪFe(OH)3��д����Ӧ�Ļ�ѧ����ʽΪ__________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������г���MnS����������ȥ��ҵ��ˮ�е�Cu2����Cu2��(aq)��MnS(s)![]() CuS(s)��Mn2��(aq)�����й���������ȷ����(����)
CuS(s)��Mn2��(aq)�����й���������ȷ����(����)
��MnS��Ksp����CuS��Ksp���ڴﵽƽ��ʱc(Mn2��)��c(Cu2��)������Һ�м�������Na2S�������Һ��c(Cu2��)��c(Mn2��)���ֲ��䡡�ܸ÷�Ӧƽ�ⳣ��K��
A. �٢� B. �ڢ�
C. �٢ڢ� D. �ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ĸ������Ϊ 0.5 L �ĺ����ܱ��������������������а���ͬͶ�ϱ�(Z)���� HCl �� O2(���±�)���������������Ӧ 4HCl(g)��O2(g) ![]() 2Cl2(g)��2H2O(g) ��H��HCl ��ƽ��ת����(��)�� Z ���¶�(T)�Ĺ�ϵ��ͼ ��ʾ������˵����ȷ����
2Cl2(g)��2H2O(g) ��H��HCl ��ƽ��ת����(��)�� Z ���¶�(T)�Ĺ�ϵ��ͼ ��ʾ������˵����ȷ����
���� | ��ʼʱ | ||
t/�� | n(HCl)��mol��1 | Z | |
I | 300 | 0.25 | a |
II | 300 | 0.25 | b |
III | 300 | 0.25 | 4 |
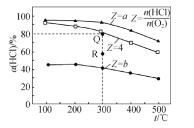
A.��H<0��b<4<a
B.300 ���÷�Ӧ��ƽ�ⳣ����ֵΪ 64
C.������ijʱ�̴��� R �㣬�� R ��� v ��>v �棬ѹǿ��p(R)>p(Q)
D.����ʼʱ�����������г��� 0.25 mol Cl2 �� 0.25 mol H2O(g)��300 ����ƽ��ʱ������ c(HCl)��0.1 mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ӱ�컯ѧ��Ӧ���ʵ����غܶ࣬ij������ȤС����ʵ�鷽������̽����
(1)ȡ�����ʵ���Ũ�ȡ��������H2O2��Һ�ֱ����H2O2�ķֽ�ʵ�飬ʵ�鱨�����±���ʾ������ͽ����ԣ���

��ʵ��1��2�о�����__________��H2O2�ֽ����ʵ�Ӱ�졣
��ʵ��2��3��Ŀ����_______________��H2O2�ֽ����ʵ�Ӱ�졣
(2)������֪��Cu2����H2O2�ֽ�Ҳ�д����ã�Ϊ�Ƚ�Fe3����Cu2����H2O2�ֽ�Ĵ�Ч������С���ͬѧ�ֱ��������ͼ�ס�����ʾ��ʵ�顣�ش�������⣺

�ٶ�����ͼ��ͨ���۲�_______�����ԱȽϵó����ۡ���ͬѧ�����CuSO4��Һ��ΪCuCl2��Һ����������������_________��
�ڶ�����ͼ����ʾ��ʵ��ʱ���ռ���40 mL����Ϊ��������������Ӱ��ʵ������أ�ʵ������Ҫ������������__________��
(3)���Ը��������Һ�Ͳ�����Һ�ɷ�����Ӧ��2KMnO4��5H2C2O4��3H2SO4=K2SO4��2MnSO4��8H2O��10CO2����ʵ��ʱ���ֿ�ʼ��Ӧ���ʽ�������Һ��ɫ�����ԣ���һ��ʱ���ͻȻ��ɫ����Ӧ�������Լӿ졣�Դ�չ�����ۣ�
��ijͬѧ��ΪKMnO4��H2C2O4�ķ�Ӧ��______�ȷ�Ӧ������_______________��
�ڴ�Ӱ�컯ѧ��Ӧ���ʵ����ؿ�������Ϊ��������________��Ӱ�졣Ҫ֤����IJ��룬ʵ�鷽����________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯������;�dz��㷺���ش��������⣺
��1����̬�ࣨSb��ԭ�Ӽ۵����Ų��Ĺ��ʽΪ____��[H2F]+[SbF6]���������ࣩ��һ�ֳ�ǿ�ᣬ����[H2F]+�������ӵĿռ乹��Ϊ______������д��һ����[H2F]+������ͬ�ռ乹�ͺͼ�����ʽ�ķ��Ӻ������ӷֱ���_______��_________��
��2�����ᣨH3BO3�����ķ�����泥�NH4BF4����������Ҫ�Ļ�����;��
��H3BO3��NH4BF4�漰������Ԫ���еڶ�����Ԫ�صĵ�һ�������ɴ�С��˳��_____����Ԫ�ط��ţ���
��H3BO3�������ܵ����H+����ˮ�����һ��OH������[B(OH)4]���������������ԡ�[B(OH)4]����Bԭ�ӵ��ӻ�����Ϊ_____��
��NH4BF4���ķ�����泥�����������ͭ�������ۼ����ܸ�ʴ�����ȡ��ķ�������д���_______������ţ���
A ���Ӽ� B �Ҽ� C �м� D ��λ�� E ���»���
��3��ij�����Ͻ�ľ�����ͼ��ʾ���谢���ӵ�������ֵΪ![]() ���þ�����ܶȦ�_________g��cm��3��
���þ�����ܶȦ�_________g��cm��3��
 ��
��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com