
【题目】二氧化硫是形成酸雨的罪魁祸首之一,含硫煤燃烧的尾气处理一直是化学研究的重要课题。某工厂设计了新的治污方法,该工艺流程如图所示,下列叙述不正确的是( )
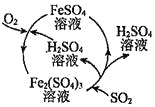
A.该过程中可得到化工产品![]()
B.该工艺流程中![]() 可以循环利用
可以循环利用
C.若处理含![]() 的尾气,理论上需要通入相同条件下的空气约
的尾气,理论上需要通入相同条件下的空气约![]()
D.可用澄清石灰水检验最终排出的气体是否含有二氧化硫
【答案】D
【解析】
根据工艺流程所示可知,该工艺中Fe2(SO4)3和H2O吸收SO2生成FeSO4和H2SO4,该反应的化学方程式为Fe2(SO4)3+2H2O+SO2=2FeSO4+2H2SO4,据此分析解答。
A.分析流程,![]() 最终转化为
最终转化为![]() ,故该过程中可得到化工产品
,故该过程中可得到化工产品![]() ,故A正确;
,故A正确;
B.![]() 与
与![]() 反应生成
反应生成![]() ,然后
,然后![]() 被氧化为
被氧化为![]() ,故该工艺流程中
,故该工艺流程中![]() 可以循环利用,故B正确;
可以循环利用,故B正确;
C.根据2SO2+O2 3SO3,若处理含![]() 的尾气,理论上需要相同条件下的氧气
的尾气,理论上需要相同条件下的氧气![]() ,氧气在空气中的体积分数约为
,氧气在空气中的体积分数约为![]() ,理论上需要通入相同条件下的空气约
,理论上需要通入相同条件下的空气约![]() ,故C正确;
,故C正确;
D.煤燃烧生成二氧化碳,最终排出的气体一定含有二氧化碳,也能使石灰水变浑浊,故D错误。
答案选D。


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:
【题目】2019年10月1日是中华人民共和国成立70周年,国庆期间对大量盆栽鲜花施用了S-诱抗素制剂以保证鲜花盛开,利用下图所示的有机物X可生产S﹣诱抗素Y.下列说法不正确的是( )

A.1mol Y与1mol Br2反应的产物有4种
B.1mol Y与足量NaOH溶液反应,最多消耗3mol NaOH
C.1mol X最多能加成7mol H2
D.X可以发生氧化、取代、酯化、加聚、缩聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机制药工业中常用以下方法合成一种药物中间体(G):


(1)G的分子式是___。
(2)化合物A中含氧官能团的名称为___。
(3)由C→D的反应类型为___;化合物E的结构简式为___。
(4)写出B→C的反应的化学方程式:___。
(5)写出同时满足下列条件的B的一种同分异构体的结构简式:___。
①能与新制Cu(OH)2在加热条件下反应生成砖红色沉淀,水解产物之一能与FeCl3溶液发生显色反应;
②核磁共振氢谱为四组峰,峰面积比为1∶2∶4∶9;
③分子中含有氨基。
(6)已知:RCN![]() RCH2NH2,请写出以HOOCCH2CH2COOH和CH3CH2Cl为原料制备
RCH2NH2,请写出以HOOCCH2CH2COOH和CH3CH2Cl为原料制备![]() 的合成路线流程图___(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图___(无机试剂任用)。合成路线流程图示例如下:
CH3CH2OH![]() CH2
CH2![]() CH2
CH2![]() CH3CH2Cl
CH3CH2Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家设计二氧化碳熔盐捕获及电化学转化装置,其示意图如下:

下列说法不正确的是
A. b为电源的正极
B. ①②中,捕获CO2时碳元素的化合价发生了变化
C. a极的电极反应式为2C2O52 4e == 4CO2 + O2
D. 上述装置存在反应:CO2 ===== C + O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】判断A(g)+B(g) ![]() C(g)+D(g)是否达到平衡的依据为( )
C(g)+D(g)是否达到平衡的依据为( )
A. 压强不随时间改变
B. 气体的密度不随时间改变
C. c(A)不随时间改变
D. 单位时间里生成C和D的物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,恒容密闭容器内某一反应体系中M、N的物质的量随反应时间变化的曲线如右图所示,下列叙述正确的是( )

A. 该反应的化学方程式为2M![]() N
N
B. t1时N的浓度是M浓度的2倍
C. t2时正、逆反应速率相等,反应达到平衡状态
D. t3时正反应速率大于逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 有相同容积的定容密封容器甲和乙,甲中加入
有相同容积的定容密封容器甲和乙,甲中加入![]() 和
和![]() 各0.1mol ,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是( )
各0.1mol ,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是( )
A.甲、乙提高相同温度 B. 甲中加入0.1mol He,乙不改变
C.甲降低温度,乙不变 D. 甲增加0.1mol ![]() ,乙增加0.1mol I2
,乙增加0.1mol I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某合金只含铝、铁、铜三种元素,取合金![]() ,加入到含
,加入到含![]() 稀硝酸的溶液中,恰好完全反应,放出无色气体
稀硝酸的溶液中,恰好完全反应,放出无色气体![]() 标准状况下
标准状况下![]() 。将反应后的溶液分成2等份,向一份溶液中滴加
。将反应后的溶液分成2等份,向一份溶液中滴加![]() ,无明显现象。向另一份溶液中滴加氨水至过量,过滤得沉淀bg,充分灼烧得固体
,无明显现象。向另一份溶液中滴加氨水至过量,过滤得沉淀bg,充分灼烧得固体![]() ,减轻了
,减轻了![]() ,再加入到过量的
,再加入到过量的![]() 溶液中,剩余不溶物
溶液中,剩余不溶物![]() 。下列说法不正确的是
。下列说法不正确的是![]()
![]()
已知:![]() 遇到
遇到![]() 会出现蓝色沉淀;
会出现蓝色沉淀; ![]()
A.![]()
B.原合金中铜的质量为![]()
C.若将上述![]() 稀硝酸逐滴加入到合金中,放出气体仍为
稀硝酸逐滴加入到合金中,放出气体仍为![]() 标准状况下
标准状况下![]()
D.d不是一确定值,可能为8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL0.5mol·L-1的盐酸与50mL0.55mol·L-1的NaOH溶液在如图所示的位置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,可知下图装置有三处不妥之处,请指出____________、_____________、________________。
(2)在测定中和热的实验中,计算反应热时需要的数据有_________
①酸的浓度和体积 ②碱的浓度和体积 ③比热容 ④反应前后溶液的温度差 ⑤操作所需时间
A.①②③⑤ B.①②③④ C.②③④⑤ D.①③④⑤
(3)实验中改用60mL0.50mol·L-1的盐酸跟50mL0.55mol·L-1的NaOH溶液进行反应,与上述实验相比,所求中和热_________(填“相等”或“不相等”),所放出的热量________(填“相等”或“不相等”)。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会______(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com