
【题目】可逆反应A2 + 3B2(?)![]() 2AB3(g)中,AB3的百分含量(w)与温度和压强的关系如图所示。下列说法正确的是( )
2AB3(g)中,AB3的百分含量(w)与温度和压强的关系如图所示。下列说法正确的是( )
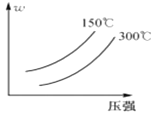
A.该反应为吸热反应
B.反应物B2为气体
C.升高温度,逆反应速率减慢
D.增大压强,A2转化率减小
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
【题目】如图所示中学化学中常见物质的实验转化过程,部分物质和反应条件略去。
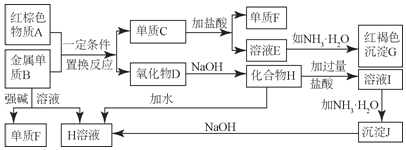
(1)写出F的化学式______;写出物质A的一种用途______;
(2)写出单质B与强碱溶液反应的离子方程式______,写出沉淀J生成H溶液的离子方程式______;
(3)溶液E中加入氨水时,先生成白色沉淀L,写出生成L的离子方程式______;
(4)溶液I中所含金属离子是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,恒容密闭容器内某一反应体系中M、N的物质的量随反应时间变化的曲线如右图所示,下列叙述正确的是( )

A. 该反应的化学方程式为2M![]() N
N
B. t1时N的浓度是M浓度的2倍
C. t2时正、逆反应速率相等,反应达到平衡状态
D. t3时正反应速率大于逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将足量Cl2缓缓通入含0.02mol H2SO3和0.02mol HBr的混合溶液中。在此过程中溶液的pH与Cl2用量的关系示意图是(溶液体积变化忽略不计,且不考虑Cl2与水反应)
A.  B.
B.  C.
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某合金只含铝、铁、铜三种元素,取合金![]() ,加入到含
,加入到含![]() 稀硝酸的溶液中,恰好完全反应,放出无色气体
稀硝酸的溶液中,恰好完全反应,放出无色气体![]() 标准状况下
标准状况下![]() 。将反应后的溶液分成2等份,向一份溶液中滴加
。将反应后的溶液分成2等份,向一份溶液中滴加![]() ,无明显现象。向另一份溶液中滴加氨水至过量,过滤得沉淀bg,充分灼烧得固体
,无明显现象。向另一份溶液中滴加氨水至过量,过滤得沉淀bg,充分灼烧得固体![]() ,减轻了
,减轻了![]() ,再加入到过量的
,再加入到过量的![]() 溶液中,剩余不溶物
溶液中,剩余不溶物![]() 。下列说法不正确的是
。下列说法不正确的是![]()
![]()
已知:![]() 遇到
遇到![]() 会出现蓝色沉淀;
会出现蓝色沉淀; ![]()
A.![]()
B.原合金中铜的质量为![]()
C.若将上述![]() 稀硝酸逐滴加入到合金中,放出气体仍为
稀硝酸逐滴加入到合金中,放出气体仍为![]() 标准状况下
标准状况下![]()
D.d不是一确定值,可能为8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.在合成氨工业中,移走NH3可增大正反应速率,提高原料转化率
B.恒温下进行的反应2NO2(g)![]() N2O4(g)达平衡时,缩小容器体积再达平衡时,气体的颜色比第一次平衡时的深,NO2的体积分数比原平衡大
N2O4(g)达平衡时,缩小容器体积再达平衡时,气体的颜色比第一次平衡时的深,NO2的体积分数比原平衡大
C.常温下,MgO(s)+C(s)=Mg(s)+CO(g)不能自发进行,则其△H>0
D.对于反应3KSCN(aq)+FeCl3(aq)![]() Fe(SCN)3(aq)+3KCl(aq),加入KCl固体,逆反应速率瞬时增大,随后正反应速率增大
Fe(SCN)3(aq)+3KCl(aq),加入KCl固体,逆反应速率瞬时增大,随后正反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝及其化合物在生产生活中具有重要的作用。
(1)铝属于活泼金属却能在空气中稳定存在,原因是![]() 用化学用语及相关文字说明表达式为______
用化学用语及相关文字说明表达式为______
(2)下列实验能比较镁和铝的金属性强弱的是______![]() 填字母序号
填字母序号![]()
![]() 测定镁和铝的导电性强弱
测定镁和铝的导电性强弱
![]() 测定等物质的量浓度的
测定等物质的量浓度的![]() 和
和![]() 溶液的pH
溶液的pH
![]() 向
向![]() 和
和![]()
![]() 中加过量NaOH溶液
中加过量NaOH溶液
(3)冶炼金属铝时,用石墨做电极电解熔融______![]() 填化学式
填化学式![]() ,液态铝在______
,液态铝在______![]() 填“阴”或“阳”
填“阴”或“阳”![]() 极得到
极得到
(4)![]() 与
与![]() 在高温下反应可制得高温结构陶瓷氮化铝
在高温下反应可制得高温结构陶瓷氮化铝![]() ,且生成
,且生成![]() 。NaN3晶体中阴、阳离子个数比为______,写出反应化学方程式为______
。NaN3晶体中阴、阳离子个数比为______,写出反应化学方程式为______
(5)聚合铝![]() 是一种新型高效的无机高分子絮凝剂,广泛用于水的处理.用铝灰、铝土矿、铝渣等为原料
是一种新型高效的无机高分子絮凝剂,广泛用于水的处理.用铝灰、铝土矿、铝渣等为原料![]() 主要成分为Al、
主要成分为Al、![]() 可制取聚合铝.实验步骤如下:
可制取聚合铝.实验步骤如下:

①写出酸溶过程中发生的非氧化还原反应的离子方程式:______
②聚合铝![]() 的分子式为
的分子式为![]() ,聚合铝中
,聚合铝中![]() 与
与![]() 的比值对净水效果有很大影响,定义盐基度
的比值对净水效果有很大影响,定义盐基度![]() :
:![]() ,当
,当![]() 时,
时,![]() ______
______![]() 填入合适数字
填入合适数字![]()
③制取聚合铝的方法有多种,若将步骤I后的溶液pH直接调制![]() 时,将在过程④发生聚合而得到某种聚合铝
时,将在过程④发生聚合而得到某种聚合铝![]() ,写出生成该聚合铝的离子反应方程式是______
,写出生成该聚合铝的离子反应方程式是______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式硫酸铁[Fe(OH)SO4]可用做净水剂、媒染剂等。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的部分工艺如下:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
开始沉淀 | 2.3 | 7.5 | 3.4 |
完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)反应Ⅰ中氧化还原反应的离子方程式__________________ 、 ___________________。
(2)反应Ⅱ中加入NaHCO3调节体系的pH在_____________范围内。
(3)反应Ⅲ中生成的气体遇空气变红棕色,该反应的离子方程式是_____________________。
(4)若反应Ⅲ中通入O2可减少NaNO2的用量,当消耗1molO2可节约n(NaNO2)=_____mol。
(5)用稀硫酸调节体系的pH时,若硫酸加入量过少,容易生成沉淀;若硫酸加入量过大,不利于产品形成,用化学平衡移动原理说明其原因______________________________。
(6)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)42+ 聚合离子,该水解反应的离子方程式为____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示的装置和其他必要的仪器用品,完成下列实验。

已知2NH3+3CuO![]() N2+3Cu+3H2O,该实验证明氨气具有还原性。
N2+3Cu+3H2O,该实验证明氨气具有还原性。
(1)碱石灰的作用是______________,倒扣漏斗的作用是___________________。
(2)浓氨水与固体NaOH接触,会逸出大量氨气原因是______________________。
(3)硬质玻璃管中可观察到的实验现象是_________________________________。
(4)常温下,若氨水与稀硫酸恰好完全中和,则所得溶液中各离子浓度的大小顺序为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com