
����Ŀ�������仯���������������о�����Ҫ�����á�
(1)�����ڻ��ý���ȴ���ڿ������ȶ����ڣ�ԭ����![]() �û�ѧ���P�������˵������ʽΪ______
�û�ѧ���P�������˵������ʽΪ______
(2)����ʵ���ܱȽ�þ�����Ľ�����ǿ������______![]() ����ĸ���
����ĸ���![]()
![]() �ⶨþ�����ĵ�����ǿ��
�ⶨþ�����ĵ�����ǿ��
![]() �ⶨ�����ʵ���Ũ�ȵ�
�ⶨ�����ʵ���Ũ�ȵ�![]() ��
��![]() ��Һ��pH
��Һ��pH
![]() ��
��![]() ��
��![]()
![]() �мӹ���NaOH��Һ
�мӹ���NaOH��Һ
(3)ұ��������ʱ����ʯī���缫�������______![]() �ѧʽ
�ѧʽ![]() ��Һ̬����______
��Һ̬����______![]() ����������������
����������������![]() ���õ�
���õ�
(4)![]() ��
��![]() �ڸ����·�Ӧ���Ƶø��½ṹ�մɵ�����
�ڸ����·�Ӧ���Ƶø��½ṹ�մɵ�����![]() ��������
��������![]() ��NaN3���������������Ӹ�����Ϊ______��д����Ӧ��ѧ����ʽΪ______
��NaN3���������������Ӹ�����Ϊ______��д����Ӧ��ѧ����ʽΪ______
(5)�ۺ���![]() ��һ������Ч�����߷������������㷺����ˮ�Ĵ����������ҡ�������������Ϊԭ��
��һ������Ч�����߷������������㷺����ˮ�Ĵ����������ҡ�������������Ϊԭ��![]() ��Ҫ�ɷ�ΪAl��
��Ҫ�ɷ�ΪAl��![]() ����ȡ�ۺ�����ʵ�鲽�����£�
����ȡ�ۺ�����ʵ�鲽�����£�

��д�����ܹ����з����ķ�������ԭ��Ӧ�����ӷ���ʽ��______
�ھۺ���![]() �ķ���ʽΪ
�ķ���ʽΪ![]() ���ۺ�����
���ۺ�����![]() ��
��![]() �ı�ֵ�Ծ�ˮЧ���кܴ�Ӱ�죬�����λ���
�ı�ֵ�Ծ�ˮЧ���кܴ�Ӱ�죬�����λ���![]() ��
��![]() ����
����![]() ʱ��
ʱ��![]() ______
______![]() �����������
�����������![]()
����ȡ�ۺ����ķ����ж��֣���������I�����ҺpHֱ�ӵ���![]() ʱ�����ڹ��̢ܷ����ۺ϶��õ�ij�־ۺ���
ʱ�����ڹ��̢ܷ����ۺ϶��õ�ij�־ۺ���![]() ��д�����ɸþۺ��������ӷ�Ӧ����ʽ��______
��д�����ɸþۺ��������ӷ�Ӧ����ʽ��______
���𰸡�![]() �����������γ����ܵ�����Ĥ���ܱ����ڲ������������ c
�����������γ����ܵ�����Ĥ���ܱ����ڲ������������ c ![]() �� 1��1
�� 1��1 
![]() 2
2 ![]()
��������
(1)���Ļ�ѧ���ʱȽϻ��ã������ڿ������ȶ����ڣ���������������ܵ�����Ĥ��
(2)������ǿ�����жϷ����У��û����������׳̶ȡ�������������ˮ����ļ���ǿ������ͬ���͵��ε�pH��С��
(3)��ҵ����ʯī���缫�缫�����������Ʊ�������������������������ԭ��Ӧ��
(4)NaN3������������ΪN3-��������ΪNa+��AlCl3��NaN3�ڸ����·�Ӧ���Ƶø��½ṹ�մɵ�����(AlN)��������N2�����ԭ���غ���ƽ��д��ѧ����ʽ��
(5)�����ܹ����з����ķ�������ԭ��Ӧ�������������ᷴӦ�����Ȼ�����ˮ��
��B= 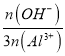 =
=![]() ʱ����n(OH-)=2n(Al3+)����[Al2(OH)aClb]m��֪a=4���ٸ��ݻ��ϼ۴�����Ϊ0����b��ֵ��
ʱ����n(OH-)=2n(Al3+)����[Al2(OH)aClb]m��֪a=4���ٸ��ݻ��ϼ۴�����Ϊ0����b��ֵ��
�۲���I�����ҺΪ������Һ����������I�����ҺpHֱ�ӵ���4.2-4.5ʱ�����ڹ���II�����ۺ϶��õ�ij�־ۺ���Alm(OH)nCl3m-n�����ԭ���غ���д��ѧ����ʽ��
(1)���ڿ������ȶ����ڣ���ԭ�����ڳ�����Al��������Ӧ�����������γ����ܵ�����Ĥ���ܱ����ڲ����������������Ӧ�Ļ�ѧ����ʽΪ��4Al+3O2=2Al2O3���ʴ�Ϊ��4Al+3O2=2Al2O3�����������γ����ܵ�����Ĥ���ܱ����ڲ��������������
(2)a�������ĵ�����ǿ������֤�������Ľ�����ǿ������a����
b���ⶨ�����ʵ���Ũ�ȵ�Al2(SO4)3��MgSO4��Һ��pH�������Ӻ�þ����Ũ�Ȳ�ͬˮ��̶Ȳ�ͬ������֤�����������ԣ���b����
c��������þ�������������ƣ������������������������ƣ�˵��������þ�ļ��Դ������������������ܱȽ����ֽ����Ľ�����ǿ������c��ȷ��
�ʴ�Ϊ��c��
(3)ұ��������ʱ����ʯī���缫�������Al2O3��������Al3++3e-=Al���ʴ�Ϊ��Al2O3������
(4)NaN3������������ΪN3-��������ΪNa+�����������������Ӹ�����Ϊ1��1��AlCl3��NaN3�ڸ����·�Ӧ���Ƶø��½ṹ�մɵ�����(AlN)��������N2�����ԭ���غ���ƽ��д��ѧ����ʽΪ��AlCl3+3NaN3 3NaCl+4N2��+AlN���ʴ�Ϊ��1��1��AlCl3+3NaN3
3NaCl+4N2��+AlN���ʴ�Ϊ��1��1��AlCl3+3NaN3 3NaCl+4N2��+AlN��
3NaCl+4N2��+AlN��
(5)�����ܹ����з����ķ�������ԭ��Ӧ�������������ᷴӦ�����Ȼ�����ˮ����Ӧ���ӷ���ʽΪ��Al2O3+6H+=2Al3++3H2O���ʴ�Ϊ��Al2O3+6H+=2Al3++3H2O��
��B== 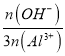 =
=![]() ʱ����n(OH-)=2n(Al3+)����[Al2(OH)aClb]m��֪a=4�����ݻ��ϼ۴�����Ϊ0��3��2+4��(-1)+b��(-1)=0�����b=2���ʴ�Ϊ��2��
ʱ����n(OH-)=2n(Al3+)����[Al2(OH)aClb]m��֪a=4�����ݻ��ϼ۴�����Ϊ0��3��2+4��(-1)+b��(-1)=0�����b=2���ʴ�Ϊ��2��
�۲���I�����ҺΪ������Һ����������I�����ҺpHֱ�ӵ���4.2-4.5ʱ�����ڹ���II�����ۺ϶��õ�ij�־ۺ���Alm(OH)nCl3m-n�����ԭ���غ���д��ѧ����ʽΪ��nAl3++(3m-n)Cl-+nH2O=Alm(OH)nCl3m-n+nH+���ʴ�Ϊ��nAl3++(3m-n)Cl-+nH2O=Alm(OH)nCl3m-n+nH+��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ӱ�컯ѧ��Ӧ���ʵ����غܶ࣬ij������ȤС����ʵ�鷽������̽����
(1)ȡ�����ʵ���Ũ�ȡ��������H2O2��Һ�ֱ����H2O2�ķֽ�ʵ�飬ʵ�鱨�����±���ʾ������ͽ����ԣ���

��ʵ��1��2�о�����__________��H2O2�ֽ����ʵ�Ӱ�졣
��ʵ��2��3��Ŀ����_______________��H2O2�ֽ����ʵ�Ӱ�졣
(2)������֪��Cu2����H2O2�ֽ�Ҳ�д����ã�Ϊ�Ƚ�Fe3����Cu2����H2O2�ֽ�Ĵ�Ч������С���ͬѧ�ֱ��������ͼ�ס�����ʾ��ʵ�顣�ش�������⣺

�ٶ�����ͼ��ͨ���۲�_______�����ԱȽϵó����ۡ���ͬѧ�����CuSO4��Һ��ΪCuCl2��Һ����������������_________��
�ڶ�����ͼ����ʾ��ʵ��ʱ���ռ���40 mL����Ϊ��������������Ӱ��ʵ������أ�ʵ������Ҫ������������__________��
(3)���Ը��������Һ�Ͳ�����Һ�ɷ�����Ӧ��2KMnO4��5H2C2O4��3H2SO4=K2SO4��2MnSO4��8H2O��10CO2����ʵ��ʱ���ֿ�ʼ��Ӧ���ʽ�������Һ��ɫ�����ԣ���һ��ʱ���ͻȻ��ɫ����Ӧ�������Լӿ졣�Դ�չ�����ۣ�
��ijͬѧ��ΪKMnO4��H2C2O4�ķ�Ӧ��______�ȷ�Ӧ������_______________��
�ڴ�Ӱ�컯ѧ��Ӧ���ʵ����ؿ�������Ϊ��������________��Ӱ�졣Ҫ֤����IJ��룬ʵ�鷽����________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯������;�dz��㷺���ش��������⣺
��1����̬�ࣨSb��ԭ�Ӽ۵����Ų��Ĺ��ʽΪ____��[H2F]+[SbF6]���������ࣩ��һ�ֳ�ǿ�ᣬ����[H2F]+�������ӵĿռ乹��Ϊ______������д��һ����[H2F]+������ͬ�ռ乹�ͺͼ�����ʽ�ķ��Ӻ������ӷֱ���_______��_________��
��2�����ᣨH3BO3�����ķ�����泥�NH4BF4����������Ҫ�Ļ�����;��
��H3BO3��NH4BF4�漰������Ԫ���еڶ�����Ԫ�صĵ�һ�������ɴ�С��˳��_____����Ԫ�ط��ţ���
��H3BO3�������ܵ����H+����ˮ�����һ��OH������[B(OH)4]���������������ԡ�[B(OH)4]����Bԭ�ӵ��ӻ�����Ϊ_____��
��NH4BF4���ķ�����泥�����������ͭ�������ۼ����ܸ�ʴ�����ȡ��ķ�������д���_______������ţ���
A ���Ӽ� B �Ҽ� C �м� D ��λ�� E ���»���
��3��ij�����Ͻ�ľ�����ͼ��ʾ���谢���ӵ�������ֵΪ![]() ���þ�����ܶȦ�_________g��cm��3��
���þ�����ܶȦ�_________g��cm��3��
 ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴ӦA2 + 3B2(?)![]() 2AB3(g)�У�AB3�İٷֺ���(w)���¶Ⱥ�ѹǿ�Ĺ�ϵ��ͼ��ʾ������˵����ȷ����( )
2AB3(g)�У�AB3�İٷֺ���(w)���¶Ⱥ�ѹǿ�Ĺ�ϵ��ͼ��ʾ������˵����ȷ����( )
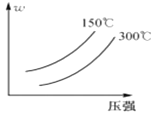
A.�÷�ӦΪ���ȷ�Ӧ
B.��Ӧ��B2Ϊ����
C.�����¶ȣ��淴Ӧ���ʼ���
D.����ѹǿ��A2ת���ʼ�С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������У��뾶���ɴ�С����˳����ȷ����
�ٻ�̬X��ԭ�ӽṹʾ��ͼ
�ڻ�̬Y�ļ۵����Ų�ʽ��3s23p5
�ۻ�̬Z2���ĵ����Ų�ͼ![]()
��W��̬ԭ����2���ܲ㣬����ʽΪ![]()
A. ��>��>��>�� B. ��>��>��>��
C. ��>��>��>�� D. ��>��>��>��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��X��һ�������г����Ľ���Ԫ�أ�A��B��C��DΪʯī�缫��E��F�ֱ�Ϊ�������������ֻ��ý����е�һ�֣���E����NaOH��Һ��Ӧ����ͼʾ��ͨ��·����Ӧһ��ʱ��(ʵ����������Һ������)��

(1)�׳���___(�ԭ��ء����ء�����ͬ)װ�ã��ҳ���___װ�á�
(2)D��Ϊ___(���������������)��
(3)�ձ�����Һ���������____(�a����b��)��C���ϵĵ缫��ӦʽΪ___________________________��
(4)F���ϵĵ缫��ӦʽΪ��_________________________________________________��
(5)����·��ͨ��0.02mol����ʱ��B�缫�ϳ���0.64g����X����XΪ___(��Ԫ�ط���)���׳��з�Ӧ�Ļ�ѧ����ʽΪ______________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ��������ʯ����̿��������ʯ��ʯΪԭ����ұ������
��1����д���ô������ڸ�����ұ�����Ļ�ѧ����ʽ___________�������û�ѧ�������ʵ�鷽������������Ӧ�õ��Ĺ�������к�������___________��
��2��С��ͬѧ����ұ�����õ����۰���ͼװ�����Ʊ� Fe(OH)2��ʵ�鿪ʼʱӦ��_______����a��___________���� b(����رա�)
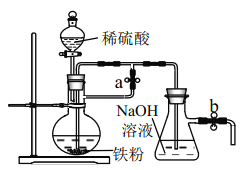
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��Ԫ�����ڱ���һ���֣�
�� | X |
Y | Z |
![]() ʱ����Ũ��Ϊ
ʱ����Ũ��Ϊ![]() ��NaOH��Һ�ֱ�ζ�
��NaOH��Һ�ֱ�ζ�![]() Ũ�Ⱦ�Ϊ
Ũ�Ⱦ�Ϊ![]() ��������HX��
��������HX��![]() ��������仯
��������仯![]() ��ʵ���������
��ʵ���������
���ݱ�� | ����NaOH��Һ����� | ��ҺpH | |
HX | HZ | ||
�� | 0 | 3 | 1 |
�� | 20.00 | a | 7 |
�����ж���ȷ����
A.������![]()
B.HX��HZ�������Ϻ�![]()
C.Y��Z��Ԫ�صļ��⻯�����ȷֽ⣬ǰ�߷ֽ��¶ȸ�
D.![]()
![]()
![]() ��ˮ��Һ�У�
��ˮ��Һ�У�![]()
![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ������˵����ȷ���� ( )
A.��״���£�0.1 mol Cl2����ˮ��ת�Ƶĵ�����ĿΪ0.2 NA
B.���³�ѹ�£�18 g H2O�к���������Ϊ10 NA
C.��״���£�11.2 L CH2Cl2�к��еķ�����ĿΪ0.5 NA
D.���³�ѹ�£�2.24 L CO��CO2��������к��е�̼ԭ����ĿΪ0.1 NA
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com