
【题目】C60、金刚石和石墨的结构模型如图所示(石墨仅表示出其中的一层结构)。
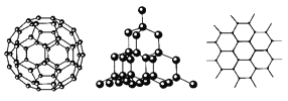
(1)C60、金刚石和石墨三者的关系互为________。
A.同分异构体 B.同素异形体
C.同系物 D.同位素
(2)固态时,C60属于________晶体(填“离子”、“原子”或“分子”),C60分子中含有双键的数目是________个。
(3)硅晶体的结构跟金刚石相似,1 mol硅晶体中含有硅硅单键的数目约是________NA个。二氧化硅的结构相当于在硅晶体结构中每个硅硅单键之间插入1个氧原子,二氧化硅的空间网状结构中,硅、氧原子形成的最小环上氧原子数目是________个。
(4)石墨层状结构中,平均每个正六边形占有的碳原子数是________个。
【答案】B 分子 30 2 6 2
【解析】
(1)同种元素的不同单质互称同素异形体;
(2)根据晶体构成微粒判断晶体类型;分子中每一碳上有一个双键,一个碳碳双键两个碳原子共用,均摊法计算;
(3)一个硅原子形成4个硅硅单键,每个键2个硅原子共用;
金刚石最小的环为六元环,二氧化硅结构跟金刚石结构相似,Si、O原子形成的最小环上应有6个Si原子,6个O原子;
(4)利用均摊法计算。
(1)同种元素的不同单质互称同素异形体,C60、金刚石和石墨三者的关系互为同素异形体,故选B。
(2)固态时,C60中构成微粒是分子,所以属于分子晶体;
分子中每一碳上有一个双键,一个碳碳双键两个碳原子共用,C60分子中含有双键的数目是![]() =30个。
=30个。
(3)硅晶体的结构跟金刚石相似,一个硅原子形成4个硅硅单键,每个键2个硅原子共用,1 mol硅晶体中含有硅硅单键的数目约是![]() =2NA个。
=2NA个。
金刚石最小的环为六元环,二氧化硅结构跟金刚石结构相似,Si、O原子形成的最小环上应有6个Si原子,硅晶体结构中每个硅与硅的化学键之间插入一个O原子,则Si、O原子形成的最小环上O原子的数目是6;
(4)石墨层状结构中,每个碳原子被三个正六边形共用,平均每个正六边形占有的碳原子数是6×![]() =2个。
=2个。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】![]() 溶液与
溶液与![]() 锌粉在量热计中充分反应。测得反应前温度为
锌粉在量热计中充分反应。测得反应前温度为![]() ,反应后最高温度为
,反应后最高温度为![]() 。
。
已知:反应前后,溶液的比热容均近似为![]() 、溶液的密度均近似为
、溶液的密度均近似为![]() ,忽略溶液体积、质量变化和金属吸收的热量。请计算:
,忽略溶液体积、质量变化和金属吸收的热量。请计算:
(1)反应放出的热量![]() _____J。
_____J。
(2)反应![]() 的
的![]() ______
______![]() (列式计算)。
(列式计算)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】太阳能路灯蓄电池是磷酸铁锂电池,其工作原理如图。M电极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜为阳离子交换膜,电池反应式为LixC6+Li1-xFePO4![]() LiFePO4+6C。下列说法正确的是( )
LiFePO4+6C。下列说法正确的是( )
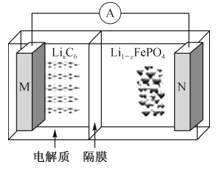
A.放电时Li+从左边移向右边,PO43-从右边移向左边
B.放电时,正极反应式为Li1-xFePO4+xLi++xe-=LiFePO4
C.充电时M极连接电源的负极,电极反应为6C+xe-=C6x-
D.紧急情况时,电解质可以用Li2SO4饱和溶液代替
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据原子结构、元素周期表和元素周期律的知识回答下列问题:
(1)A元素次外层电子数是最外层电子数的![]() ,其外围电子排布图是__________。
,其外围电子排布图是__________。
(2)B是1~36号元素原子核外电子排布中未成对电子数最多的元素,B元素的名称是____,价层电子排布式_________,在元素周期表中的位置是____________。
(3)C元素基态原子的电子排布图是下图中的____(填序号),另一个不能作为基态原子的电子排布图因为它不符合__(填序号)。
①
②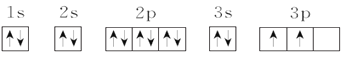
A.能量最低原理 B.泡利原理 C.洪特规则
(4)第三周期元素的气态电中性基态原子失去最外层一个电子转化为气态基态正离子所需的最低能量叫作第一电离能(设为E)。如图所示:
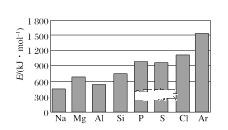
①同周期内,随着原子序数的增大,E值变化的总趋势是____;
②根据图中提供的信息,可推断出E氧____E氟(填“>”“<”或“=”,下同);
③根据第一电离能的含义和元素周期律,可推断出E镁___E钙。
(5)判断BCl3分子的空间构型、中心原子成键时采取的杂化轨道类型及分子中共价键的键角:________、___________、____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化碳结构如下图所示,其硬度超过金刚石晶体,成为首屈一指的超硬新材料。下列有关氮化碳的说法不正确的是 ( )
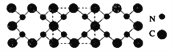
A. 氮化碳属于原子晶体
B. 氮化碳中碳显-4价,氮显+3价
C. 氮化碳的化学式为C3N4
D. 每个碳原子与四个氮原子相连,每个氮原子与三个碳原子相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)在地壳中含量不大,但砷的化合物却丰富多彩。
(1)基态砷原子的电子排布式为________;砷与溴的第一电离能较大的是____________。
(2)AsH3是无色稍有大蒜味的气体。AsH3的沸点高于PH3,其主要原因是________________________________________________________________。
(3)Na3AsO4可作杀虫剂。AsO43-的空间构型为________,与其互为等电子体的一种分子为________。
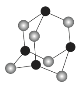
(4)某砷的氧化物俗称“砒霜”,其分子结构如图所示。该化合物的分子式为____________,As原子采取________杂化。
(5)GaAs等是人工合成的新型半导体材料,其晶体结构与金刚石相似,GaAs晶体中,As与Ga之间存在的化学键有________(填字母)。
A.离子键 B.σ键 C.π键 D.氢键 E.配位键 F.金属键 G.极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 X、Y、Z、W 原子序数依次增大,X 是地壳中含量最多的元素,Y 原子的最外层只有一个电子,Z 位于元素周期表ⅢA族,W 与X属于同一主族。下列说法正确的是
A. 原子半径:r(W) > r(Z) > r(Y)
B. 由X、Y 组成的化合物中均不含共价键
C. Y 的最高价氧化物的水化物的碱性比Z的弱
D. X 的简单气态氢化物的热稳定性比W的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据官能团的不同对下列有机物进行分类:
①CH3CH2OH ②![]() ③CH3CH2Br ④
③CH3CH2Br ④![]() ⑤
⑤![]() ⑥
⑥![]() ⑦
⑦![]() ⑧
⑧ ⑨
⑨![]() ⑩
⑩![]()
(1)芳香烃:___;卤代烃:___。
(2)醇:___;酚:___;醛:___;酮:___。
(3)羧酸:___;酯:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某芳香烃A,分子式为C8H10 ;某烃类衍生物X,分子式为C15H14O3,能使FeCl3溶液显紫色;J分子内有两个互为对位的取代基。在一定条件下有如下的转化关系(无机物略去):
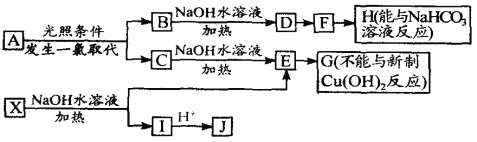
(1)属于芳香烃类的A的一种同分异构体(不包括A)中,在同一平面的原子最多有_____________个;
(2)J中所含的含氧官能团的名称为______________。
(3)E与H反应的化学方程式是_______________________;反应类型是__________ 。
(4)B、C的混合物在NaOH乙醇溶液中加热可以生成同一种有机物M,以M为单体合成的高分子化合物的名称是________________
(5)已知J有多种同分异构体,写出一种符合下列性质的J的同分异构体的结构简式。①与FeCl3溶液作用显紫色;②与新制Cu(OH)2悬浊液作用产生红色沉淀;③苯环上的一卤代物有2种。____________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com