
分析 (1)H2S和KMnO4反应生成S、MnSO4、K2SO4和H2O,结合原子守恒书写化学方程式;
(2)电离常数越小,对应的盐溶液的碱性越强;
(3)将黑色的Fe2S3固体加入足量的盐酸中,生成H2S和氯化铁,氯化铁可氧化H2S生成S,加入氢氧化钠,可生成氢氧化亚铁,氢氧化亚铁被氧化生成氢氧化铁.
解答 解:(1)H2S和KMnO4反应生成S、MnSO4、K2SO4和H2O,反应的方程式为3H2SO4+5H2S+2KMnO4=5S↓+2MnSO4+K2SO4+8H2O,
故答案为:3H2SO4+5H2S+2KMnO4=5S↓+2MnSO4+K2SO4+8H2O;
(2)H2S第二步电离常数最小,则硫化钠易水解,溶液的碱性较强,
故答案为:硫化钠溶液;硫氢根离子的电离常数小于碳酸氢根离子,则其水解程度大于碳酸根离子;
(3)将黑色的Fe2S3固体加入足量的盐酸中,生成H2S和氯化铁,氯化铁可氧化H2S生成S,加入氢氧化钠,可生成氢氧化亚铁,氢氧化亚铁被氧化生成氢氧化铁,可观察到产生白色絮状沉淀,迅速变为灰绿色,最终变为红褐色沉淀,
故答案为:氯化亚铁、硫化氢;产生白色絮状沉淀,迅速变为灰绿色,最终变为红褐色沉淀.
点评 本题为2014年上海考题改编题,考查含硫物质的综合应用,弱电解质的电离等知识,侧重于学生的分析能力的考查,注意相关知识的积累,难度中等.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:解答题
| 序号 | 溶液中的盐 | 固体不溶物的成分 |
| ① | FeCl2、CuCl2、FeCl3 | |
| ② | 无 | |
| ③ | FeCl2、CuCl2 | |
| ④ | Cu | |
| ⑤ | Fe、Cu |
| 组别 | ① | ② | ③ | ④ |
| 混合粉末质量/g | 40 | 40 | 40 | 40 |
| FeCl3溶液体积/mL | 150 | 300 | 330 | 350 |
| 反应后剩余固体质量/g | 23.2 | 6.4 | 2.56 | x |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中所有原子在同一平面 | |
| B. | 在ABn型分子中,A原子最外层电子不一定都成键 | |
| C. | 在ABn分子中,A元素为最高正价 | |
| D. | 分子中不含氢原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
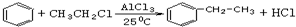
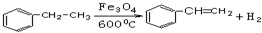 ;试以乙烯、苯、食盐、水等为原料制备苯乙醇 (
;试以乙烯、苯、食盐、水等为原料制备苯乙醇 (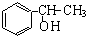 ),写出各步反应的化学方程式:
),写出各步反应的化学方程式: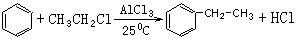 ;
;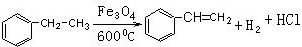 ;
;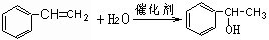 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | TiC中钛元素-4价 | B. | 每生成1molTiC转移电子4mol | ||
| C. | TiO2是氧化剂,Al,C是还原剂 | D. | TiC不属于新型无机非金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把X和Y组成的合金放于潮湿的空气中,X先被腐蚀 | |
| B. | X原子最外层电子数比Y原子最外层电子数少 | |
| C. | X能从Y的盐溶液中把Y置换出来 | |
| D. | X的最高价氧化物的水化物碱性比Y的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴苯中混有溴,加入KI溶液,振荡,用汽油萃取出I2 | |
| B. | 乙烷中混有乙烯,通过氢气在一定条件下反应,使乙烯转化为乙烷 | |
| C. | 乙烯中混有CO2和SO2,将其通过盛有NaOH溶液的洗气瓶,再干燥 | |
| D. | 除去乙醇中的微量水可加入金属钠,使其完全反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com