
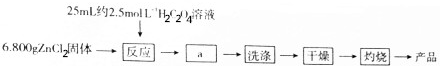
分析 (1)根据反应原理可知,H2C2O4过量可以使氯化锌充分转化成ZnC2O4•2H2O沉淀,根据配制一定物质的量浓度溶液的操作可知,需要用到烧杯、容量瓶、托盘天平、胶头滴管等,据此答题;
(2)a操作是将ZnC2O4•2H2O沉淀从混合溶液中分离出来,可以用过滤操作,过滤前加入乙醇,可以减小ZnC2O4•2H2O的溶解度,便于ZnC2O4•2H2O充分析出;
(3)ZnC2O4•2H2O沉淀表面可能有可溶性杂质含有氯离子,可以通过检验氯离子判断是否已洗涤干净;
(4)灼烧在氧气气氛中进行可以将草酸根充分氧化成二氧化碳,得到较纯的氧化锌,可以通过恒重法判断灼烧时已完全分解;
(5)根据锌元素守恒可计算出氧化锌的理论质量,根据产率=$\frac{实际产量}{理论产量}$×100%计算;
解答 解:(1)根据反应原理可知,H2C2O4过量可以使氯化锌充分转化成ZnC2O4•2H2O沉淀,根据配制一定物质的量浓度溶液的操作可知,需要用到烧杯、容量瓶、托盘天平、胶头滴管等,故选ABCD,
故答案为:氯化锌充分转化成ZnC2O4•2H2O沉淀;ABCD;
(2)a操作是将ZnC2O4•2H2O沉淀从混合溶液中分离出来,可以用过滤操作,过滤前加入乙醇,可以减小ZnC2O4•2H2O的溶解度,便于ZnC2O4•2H2O充分析出,
故答案为:过滤;减小ZnC2O4•2H2O的溶解度,便于ZnC2O4•2H2O充分析出;
(3)ZnC2O4•2H2O沉淀表面可能有可溶性杂质含有氯离子,可以通过检验氯离子判断是否已洗涤干净,具体操作为取最后一次洗涤滤液,滴加硝酸酸化的硝酸银,看是否有沉淀出现,若有沉淀,则洗涤未干净,若无则干净,
故答案为:取最后一次洗涤滤液,滴加硝酸酸化的硝酸银,看是否有沉淀出现,若有沉淀,则洗涤未干净,若无则干净;
(4)灼烧在氧气气氛中进行可以将草酸根充分氧化成二氧化碳,得到较纯的氧化锌,说明灼烧时已完全分解的方法是将加热后固体冷却称重,再加热、冷却再称重,直到两次质量相差小于0.1g即可说明已完全分解,
故答案为:将草酸根充分氧化成二氧化碳;将加热后固体冷却称重,再加热、冷却再称重,直到两次质量相差小于0.1g即可说明已完全分解;
(5)6.800gZnCl2中,锌元素的物质的量为$\frac{6.800g}{136g/mol}$=0.05mol,根据据锌元素守恒可知氧化锌的理论质量为0.05mol×81g/mol=4.05g,所以氧化锌的产率=$\frac{3.240g}{4.05g}$×100%=80%,
故答案为:80%;
点评 本题考查学生对纳米氧化锌工艺的反应条件的理解、阅读获取信息能力,是对所学知识的综合运用与能力的考查,需要学生具备扎实的基础知识与综合运用知识、信息进行解决问题的能力,题目难度中等.


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
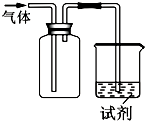 如图装置可用于收集气体并验证其化学性质,下列对应关系完全正确的是( )
如图装置可用于收集气体并验证其化学性质,下列对应关系完全正确的是( )| 选项 | 气体 | 试剂 | 现象 | 结论 |
| A | NO | 紫色石蕊试液 | 溶液变红 | NO与水反应生成硝酸 |
| B | Cl2 | KI淀粉溶液 | 溶液变蓝 | Cl2有氧化性 |
| C | SO2 | 酸性KMnO4溶液 | 溶液褪色 | SO2有漂白性 |
| D | NH3 | 酚酞试剂 | 溶液变红 | NH3有碱性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将输油铁管埋在潮湿.疏松的土壤中 | |
| B. | 经常用自来水冲洗钢铁制品 | |
| C. | 将输送自来水的铁管表面镀锌 | |
| D. | 把钢铁雕塑焊接在铜质基座上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N | B. | O | C. | Na | D. | S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4、C2H2、HCN都是含有极性键的非极性分子 | |
| B. | CO2与SO2的空间构型相似,都是非极性分子 | |
| C. | HC≡C一CH(CH3)-CH=CH一CH3分子中含有1个手性碳原子 | |
| D. | 无机含氧酸分子中有几个氢原子,它就属于几元酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 序号 | 0.01mol/L KIO3酸性溶液 (含淀粉)的体积/mL | 0.01mol/L Na2SO3溶 液的体积/mL | 水的体 积/mL | 实验温 度/℃ | 出现蓝色 的时间/s |
| ① | 5 | 5 | V1 | 0 | |
| ② | 5 | 5 | 40 | 25 | |
| ③ | 5 | V2 | 35 | 25 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 36 | B. | 49 | C. | 48 | D. | 64 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com