
| A. | 将输油铁管埋在潮湿.疏松的土壤中 | |
| B. | 经常用自来水冲洗钢铁制品 | |
| C. | 将输送自来水的铁管表面镀锌 | |
| D. | 把钢铁雕塑焊接在铜质基座上 |
 巧学巧练系列答案
巧学巧练系列答案 课课练江苏系列答案
课课练江苏系列答案科目:高中化学 来源: 题型:选择题
| A. | AlCl3溶液和Al2(SO4)3溶液加热、蒸发、浓缩、结晶、灼烧,所得固体的成分相同 | |
| B. | 配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,然后再用水稀释到所需的浓度 | |
| C. | TiCl4+(x+2)H2O(过量)?TiO2•xH2O↓+4HCl 工业上利用该反应制备TiO2纳米粉 | |
| D. | 泡沫灭火器中常使用的原料是碳酸钠和硫酸铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠跟水反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 铁粉跟稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氢氧化钡溶液跟稀硫酸反应:Ba2++SO42-═BaSO4↓ | |
| D. | 碳酸钙跟盐酸反应:CO32-+2H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
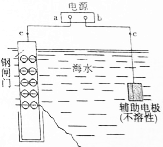 金属是日常生活和工农业生产中广泛使用的材料.恰当的金属防腐方法是延长金属材料使用寿命的前提.
金属是日常生活和工农业生产中广泛使用的材料.恰当的金属防腐方法是延长金属材料使用寿命的前提.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
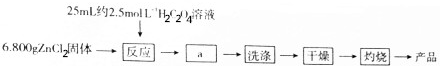
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
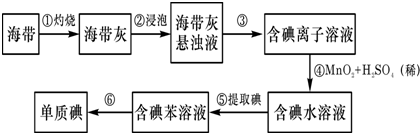
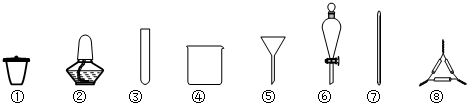
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com