

| A. | 原子 | B. | 分子 | C. | 单质 | D. | 元素 |
 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
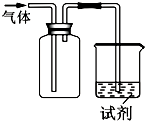 如图装置可用于收集气体并验证其化学性质,下列对应关系完全正确的是( )
如图装置可用于收集气体并验证其化学性质,下列对应关系完全正确的是( )| 选项 | 气体 | 试剂 | 现象 | 结论 |
| A | NO | 紫色石蕊试液 | 溶液变红 | NO与水反应生成硝酸 |
| B | Cl2 | KI淀粉溶液 | 溶液变蓝 | Cl2有氧化性 |
| C | SO2 | 酸性KMnO4溶液 | 溶液褪色 | SO2有漂白性 |
| D | NH3 | 酚酞试剂 | 溶液变红 | NH3有碱性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属Na着火,可立即用水扑灭 | |
| B. | 炒菜时油锅里着火了,可关掉火源并用锅盖盖灭 | |
| C. | 贮氯罐意外泄漏,应向贮氯罐周围空中喷洒稀NaOH溶液 | |
| D. | 闻氯气的气味时,应用手在瓶口轻轻煽动,使少量氯气进入鼻孔 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 尼古丁中C、H、N三种元素的质量比为5:7:1 | |
| B. | 吸烟有害健康 | |
| C. | CO比O2更易同血红蛋白结合,会导致人体缺氧 | |
| D. | 尼古丁中氮元素的质量分数约为17.3% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 叙述I | 叙述II |
| A | 实验室常用Al2(SO4)3溶液与氨水溶液制备Al(OH)3沉淀 | Al(OH)3不溶于碱 |
| B | NaHCO3为强碱弱酸盐 | NaHCO3溶液显碱性 |
| C | SO2具有氧化性 | SO2可用品红溶液检验 |
| D | 明矾水解产生具有吸附性的胶体 | 明矾可作自来水消毒 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将输油铁管埋在潮湿.疏松的土壤中 | |
| B. | 经常用自来水冲洗钢铁制品 | |
| C. | 将输送自来水的铁管表面镀锌 | |
| D. | 把钢铁雕塑焊接在铜质基座上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 序号 | 0.01mol/L KIO3酸性溶液 (含淀粉)的体积/mL | 0.01mol/L Na2SO3溶 液的体积/mL | 水的体 积/mL | 实验温 度/℃ | 出现蓝色 的时间/s |
| ① | 5 | 5 | V1 | 0 | |
| ② | 5 | 5 | 40 | 25 | |
| ③ | 5 | V2 | 35 | 25 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com