
【题目】现设计如下路线合成有机物E(C6H8O4),(其中A的相对分子质量是56,B的相对分子质量是125)。

(1)烃A的分子式是,D的结构简式为______________;
(2)③的反应类型是____________反应;
(3)已知E为顺式结构,则其结构简式是____________;
(4)下列说法正确的是____________(填序号)
a.反应①属于加成反应
b.B与二氯甲烷互为同系物
c.C存在立体异构体
d.D能使溴水褪色
(5)若C转化为D经过如下4步反应完成:![]() 。
。
则④的化学方程式是____________,⑥所需的无机试剂及反应条件是____________。
【答案】
(1)C4H8;HOOCCH=CHCOOH
(2)取代(或酯化)
(3) ![]()
(4)c d
(5)![]() ;NaOH 的醇溶液、加热
;NaOH 的醇溶液、加热
【解析】
试题分析:烃A的相对分子质量是56,由转化关系中C的分子式C4H8O2可知,A分子中含有4个碳原子,故含有氢原子数目为![]() =8,故A的分子式为C4H8,由转化关系可知,B为氯代烃,B的相对分子质量为125,B为二元氯代烃,故C为二元醇,由C与D(C4H4O4)的分子式可知,C发生氧化反应生成D,且D为二元羧酸,D的不饱和度为
=8,故A的分子式为C4H8,由转化关系可知,B为氯代烃,B的相对分子质量为125,B为二元氯代烃,故C为二元醇,由C与D(C4H4O4)的分子式可知,C发生氧化反应生成D,且D为二元羧酸,D的不饱和度为![]() ×(4×2+24)=3,故D中含有C=C双键,D的结构简式为HOOC-CH=CH-COOH,逆推可知,C为HOCH2-CH=CH-CH2OH,B为ClCH2-CH=CH-CH2Cl,A为CH3CH=CHCH3,D与CH3OH在浓硫酸、加热条件下发生酯化反应生成E(C6H8O4),故E的结构简式为CH3OOC-CH=CH-COOCH3,
×(4×2+24)=3,故D中含有C=C双键,D的结构简式为HOOC-CH=CH-COOH,逆推可知,C为HOCH2-CH=CH-CH2OH,B为ClCH2-CH=CH-CH2Cl,A为CH3CH=CHCH3,D与CH3OH在浓硫酸、加热条件下发生酯化反应生成E(C6H8O4),故E的结构简式为CH3OOC-CH=CH-COOCH3,
(1)由上述分析可知,烃A的分子式为C4H8,D的结构简式为HOOC-CH=CH-COOH,故答案为:C4H8;HOOCCH=CHCOOH
(2)反应③是HOOC-CH=CH-COOH与CH3OH在浓硫酸、加热条件下发生酯化反应生成E(C6H8O4),属于取代反应,故答案为:取代反应(酯化反应);
(3)E的结构简式为CH3OOC-CH=CH-COOCH3,为顺式结构,故其结构为:![]() ,故答案为:
,故答案为:![]() ;
;
(4)a.反应①是CH3CH=CHCH3与氯气反应生成ClCH2-CH=CH-CH2Cl,属于取代反应,故a错误;b.B中含有C=C双键,与二氯甲烷不是同系物,故b错误;c.C为HOCH2-CH=CH-CH2OH,存在立体异构体,故c正确;d.D的结构简式为HOOC-CH=CH-COOH,能使溴水褪色,故d正确;故答案为:cd;
(5)C转化为D经过如下4步反应完成:![]() ,反应④与HCl发生加成反应,保护C=C双键被酸性高锰酸钾氧化,反应方程式为:
,反应④与HCl发生加成反应,保护C=C双键被酸性高锰酸钾氧化,反应方程式为:![]() ,反应⑥在氢氧化钠醇溶液、加热条件下发生消去反应,还原C=C双键,故答案为:
,反应⑥在氢氧化钠醇溶液、加热条件下发生消去反应,还原C=C双键,故答案为: ![]() ;氢氧化钠醇溶液、加热。
;氢氧化钠醇溶液、加热。


 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
【题目】工业上常利用铝粉和氧化铁反应来焊接铁轨。下列说法正确的是
A.氧化铝、氧化铁均为两性氧化物
B.氧化铝中的微粒半径:r(Al3+)>r(O2-)
C.在该反应中,铝的还原性强于铁的还原性
D.1mol氧化铁参加反应转移电子数约为4×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂—磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:2Na3PO4+4CuSO4+2NH3·H2O===Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)与NH3互为等电子体的分子、离子有________、________(各举一例)。
(2)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则1 mol CN-中含有的π键的数目为________;若此离子与[Cu(H2O)4]2+结构相似,则此离子的空间构型为 。
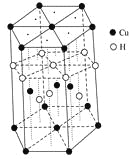
(3)Cu元素与H元素可形成一种红色化合物,其晶体结构单元如图所示。则该化合物的化学式为________。
(4) 甲醛(H2C=O)在Ni催化作用下加氢可得甲醇(CH3OH)。甲醇分子内的O-C-H键角________(填“大于”、“等于”或“小于”)甲醛分子内的O-C-H键角;甲醇易溶于水的原因是 。
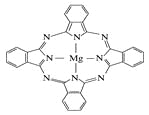
(5) 金属酞菁配合物在硅太阳能电池中有重要作用,一种金属镁酞菁配合物的结构如图所示,其中N原子的杂化方式为 ,在如图的方框内请在图中用箭头表示出配位键。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来各国都在寻找对环境无害而作用快速的消毒剂,其中二氧化氯(ClO2)是目前国际上倍受瞩目的第四代高效、无毒的消毒剂。工业上用潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某兴趣小组的学生设计了如下模拟装置来制取、收集ClO2并测定其质量。
查阅资料:ClO2是一种黄红色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,温度过高可能引起爆炸,易溶于水,易与碱液反应。


实验Ⅰ:制取并收集ClO2,如图1装置所示。
(1)装置A中反应产物有K2CO3、ClO2和CO2等,请写出该反应的化学方程式__________。
(2)装置A必须添加温度控制装置,其温度要保持在60~80℃之间,控制温度的目的是__________。装置B也必须添加温度控制装置,应该是__________(填“冰水浴”或“沸水浴”或“60℃的热水浴”)装置。
实验Ⅱ:测定ClO2质量,如图2装置所示。过程如下:
在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加3mL硫酸溶液;按照图2组装好仪器;在玻璃液封管中加入水,浸没导管口;将生成的ClO2气体由导管通入锥形瓶的溶液中充分吸收后,把玻璃液封管中的水封液倒入锥形瓶中,再向锥形瓶中加入几滴淀粉溶液:用cmol/L硫代硫酸钠标准液滴定锥形瓶中的液体,共用去VmL硫代硫酸钠溶液(己知:I2+2S2O32-=2I-+S4O62-)。
(3)装置中玻璃液封管的作用是____________________。
(4)滴定终点的现象是____________________。
(5)测得通入ClO2的质量m(ClO2)=__________g(用整理过的含c、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
I.已知: ① 4HCl(g)+O2(g) ![]() 2Cl2(g)+2H2O(g)△H=-115.6kJ/mol
2Cl2(g)+2H2O(g)△H=-115.6kJ/mol
②H2(g)+Cl2(g)=2HCl(g)△H=-184kJ/mol
由知断开1mol H-H键所需能量为436kJ;断开1molO=O键所需能量为496kJ;断开1molCl-Cl键所需能量为243KJ。则
(1)H2与O2反应生成气态水的热化学方程式是
(2)断开1molH-O键所需能量为 kJ。
Ⅱ.已知: CH4(g)+H2O(g)═CO(g)+3H2(g) △H=+206.2kJmol-1 ①
CH4(g)+CO2(g)═2CO(g)+2H2(g) △H=+247.4kJmol-1 ②
又知CH4的燃烧热为890.3kJ/mol。
(1)利用上述已知条件写出甲烷完全燃烧的热化学方程式: 。
(2)以甲烷为原料制取氢气是工业上常用的制氢方法,CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为________________________________。
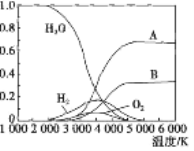
(3)高温下H2O可分解生成分子或原子。高温下水分解体系中主要气体的体积分数与温度的关系如图所示。图中B表示的微粒是_______(填名称),等质量的A、H2化学能较低的物质是_______(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是稀硫酸与某金属反应的实验数据:

分析上述数据,回答下列问题:
(1) 实验4和5表明_________对反应速率有影响;________,反应速率越快,能表明这一规
律另一组实验是___________(填实验序号)。
(2) 在前4次实验中,能表明反应物浓度对反应速率产生影响的实验有____(填序号)。
(3) 本实验中影响反应速率的其他因素还有_________,其实验序号是_____。
(4) 实验中,反应前后溶液的温度变化值(约15℃)相近,推测其原因:
_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇可以补充和部分替代石油燃料,缓解能源紧张。利用CO可以合成甲醇。
(1)已知:CO(g)+![]() O(g)=CO2(g) △H1=-283.0kJ·mol-1
O(g)=CO2(g) △H1=-283.0kJ·mol-1
H2(g)+ ![]() O2(g)=H2O(l) △H2=-285.8kJ·mol-1
O2(g)=H2O(l) △H2=-285.8kJ·mol-1
CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l) △H3=-764.5kJ·mol-1
O2(g)=CO2(g)+2H2O(l) △H3=-764.5kJ·mol-1
则CO(g)+2H2(g)=CH3OH(g) △H=__________kJ·mol-1
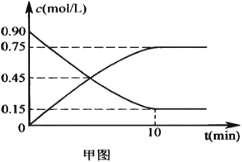
(2)甲图是反应时CO和CH3OH(g)的浓度随时间的变化情况。从反应开始到达平衡,用H2表示平均反应速率v(H2)=____________________。
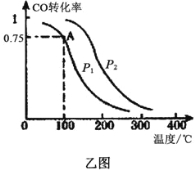
(3)一定条件下,在容积为VL的密闭容器中充入amolCO与2amolH2合成甲醇,平衡转化率与温度、压强的关系如乙图所示。
①P1__________P2(填“>”、“<”或“=”)
②该甲醇合成反应在A点的平衡常数K=__________(用a和V表示)
③下列措施中能够同时满足增大反应速率和提高CO转化率的是__________。(填写相应字母)
A.使用高效催化剂B.降低反应温度
C.增大体系压强D.不断将CH3OH从反应混合物中分离出来
E.向体系中再充入amolCO与2amolH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的电镀污泥中含有铜、铁等金属化合物。为实现资源的回收利用并有效防止环境污染,设计如下工艺流程:

沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀的pH | 2.3 | 7.6 | 4.4 |
完全沉淀的pH | 3.2 | 9.7 | 6.4 |
(1)酸浸后加入H2O2的目的是 。调pH步骤中加入的试剂最好是 (填化学式)。实验室进行过滤操作所用到的玻璃仪器有 、 、 。
(2)煮沸CuSO4溶液的原因是 。向CuSO4溶液中加入一定量的NaCl、Na2SO3,可以生成白色的CuCl沉淀,写出该反应的化学方程式 。
(3)Fe3+发生水解反应Fe3++3H2O![]() Fe(OH)3+3H+,该反应的平衡常数表达式为 。
Fe(OH)3+3H+,该反应的平衡常数表达式为 。
(4)称取所制备的CuCl样品0.250 0 g置于一定量的0.5 mol·L-1FeCl3溶液中,待样品完全溶解后,加水20 mL,用0.100 0 mol·L-1的Ce(SO4)2溶液滴定,到达终点时消耗Ce(SO4)2溶液25.00 mL。有关的化学反应为Fe3++CuCl=Fe2++Cu2++Cl-,Ce4++Fe2+=Fe3++Ce3+。计算该CuCl样品的质量分数 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修5:有机化学基础】
有机物A(C11H12O5)同时满足下列条件:①含苯环且不含甲基;②苯环上一氯取代物只有2种;③1 mol A与足量的NaHCO3反应生成1 mol CO2;④遇FeCl3溶液不显色。A有如图所示转化关系:

已知:
回答下列问题:
(1)A中有 种官能团,H的分子式为 。
(2)由C生成G的反应类型是 。
(3)G的结构简式为 ,K的结构简式为 。
(4)①写出C→D反应的化学方程式 ;
②写出I→J反应的离子方程式 。
(5)①C的同分异构体中能同时满足下列条件:a.能发生银镜反应,b.能发生皂化反应;c.能与Na反应产生H2气,共有 种(不含立体异构)。其中核磁共振氢谱显示为3组峰,且峰面积比为6﹕1﹕1的是 (写结构简式)。
②C的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是___________(填标号)。
A.元素分析仪 B.质谱仪 C.红外光谱仪 D.核磁共振仪
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com