
【题目】锂—磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:2Na3PO4+4CuSO4+2NH3·H2O===Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)与NH3互为等电子体的分子、离子有________、________(各举一例)。
(2)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则1 mol CN-中含有的π键的数目为________;若此离子与[Cu(H2O)4]2+结构相似,则此离子的空间构型为 。
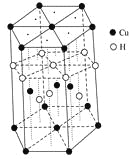
(3)Cu元素与H元素可形成一种红色化合物,其晶体结构单元如图所示。则该化合物的化学式为________。
(4) 甲醛(H2C=O)在Ni催化作用下加氢可得甲醇(CH3OH)。甲醇分子内的O-C-H键角________(填“大于”、“等于”或“小于”)甲醛分子内的O-C-H键角;甲醇易溶于水的原因是 。
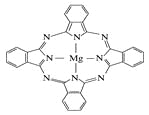
(5) 金属酞菁配合物在硅太阳能电池中有重要作用,一种金属镁酞菁配合物的结构如图所示,其中N原子的杂化方式为 ,在如图的方框内请在图中用箭头表示出配位键。
【答案】(1)PH3、H3O+
(2)2NA 平面正方形
(3)CuH
(4)小于 甲醇分子和水分子间能够形成氢键,且甲醇和水都是极性分子,相似相溶。
(5)sp2、sp3 
【解析】试题分析:(1)原子数和价电子数分别都相等的是等电子体,则与NH3互为等电子体的分子、离子有PH3、H3O+;
(2)一个 CN-中含有2个π键,所以1mol CN-中含有的π键的数目为:2NA,若此配离子[Cu(H2O)4]2+是正四面体结构,此配离子与[Cu(H2O)4]2+结构相似,则此配离子的空间构型为平面正方形;
(3)该晶胞中,铜原子个数=4+2×![]() +12×
+12×![]() =7,H原子个数=1+3+6×
=7,H原子个数=1+3+6×![]() =7,所以其化学式为CuH;
=7,所以其化学式为CuH;
(4)甲醇分子内C的成键电子对数为4,无孤电子对,杂化类型为sp3,是四面体结构,甲醛分子中的碳采取sp2杂化,是平面三角形结构,甲醇分子内O﹣C﹣H键角比甲醛分子内O﹣C﹣H键角小;由于甲醇分子和水分子间能够形成氢键,且甲醇和水都是极性分子,相似相溶,所以甲醇易溶于水。
(5)根据示意图可判断形成双键的氮原子是sp2杂化,全部形成单键的是sp3杂化;配位键由提供孤电子对的原子指向提供空轨道的原子,其中Mg提供空轨道,所以该配合物中的配位键可表示为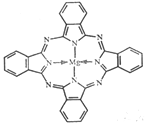 。
。


科目:高中化学 来源: 题型:
【题目】21世纪是钛的世纪。下面是利用钛白粉(TiO2)生产海绵钛(Ti)的一种工艺流程:
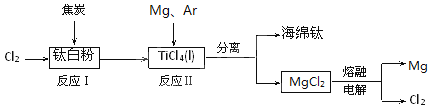
已知:
① Mg(s)+Cl2 (g)=MgCl2 (s) △H=-641 kJ·mol-1
② Cl2(g)+1/2Ti (s)=1/2TiCl4 (l) △H=-385 kJ·mol-1
(1)反应Ⅰ在800~900℃下进行,还生成一种可燃性无色气体,
该反应的化学方程式为 。
(2)反应Ⅱ的热化学方程式为 。
(3)反应Ⅱ中充入气体Ar的原因是 。
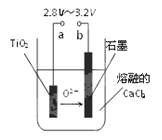
(4)在800℃~1000℃时电解TiO2也可制得海绵钛,装置如右上图所示。
图中b是电源的 极,阴极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ:硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。为测定补血剂中铁元素的含量,某化学兴趣小组设计了两套实验方案:
方案一 滴定法 用酸性KMnO4溶液滴定测定铁元素的含量。
反应原理:5Fe2++MnO+8H+===5Fe3++Mn2++4H2O
(1)实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需_________________(填仪器名称)。
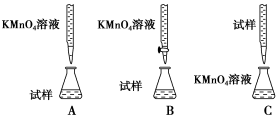
(2)某同学设计的下列滴定方式中,最合理的是___________(夹持部分略去)(填字母序号)。
方案二 重量法 操作流程如下:

(3)若省略步骤②,则加入过量X溶液后会产生白色沉淀,请写出该沉淀在空气中变质的方程式:______________________________________________。
(4)步骤④中一系列操作依次是:过滤、洗涤、灼烧、冷却、称量。
II:六水合硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]为浅绿色晶体,易溶于水,不溶于酒精,在水中的溶解度比FeSO4或(NH4)2SO4都要小。实验室中常以废铁屑为原料来制备,其步骤如下:
图1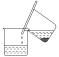 图2
图2
步骤1:铁屑的处理。将废铁屑放入热的碳酸钠溶液中浸泡几分钟后,用图1所示的倾析方法分离出固体并洗涤、干燥。
步骤2:FeSO4溶液的制备。向锥形瓶中加入30mL的3 mol·L-1H2SO4溶液,再加入过量的铁屑,加热至充分反应为止。趁热过滤(如图2所示),收集滤液和洗涤液。
步骤3:六水合硫酸亚铁铵的制备。向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,所得溶液经过一系列操作、洗涤后得到六水合硫酸亚铁铵晶体。
请回答下列问题:
(1)趁热过滤的目的和理由是________________________________________________。
(2) ①步骤3中的一系列操作包括:_________________________________。
②洗涤硫酸亚铁铵晶体最好用什么试剂:_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学 选修2:化学与技术]
铵盐是重要的化工原料,以N2和H2为原料制取硝酸铵的流程图如下,请回答下列问题:

(1)在上述流程图中,B设备的名称是 ,其中发生反应的化学方程式为 。
(2)在上述工业生产中,N2与H2合成NH3的催化剂是 。1909年化学家哈伯在实验室首次合成了氨,2007年化学家格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意图如下:

![]() 分别表示N2、H2、NH3 。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是 、 。
分别表示N2、H2、NH3 。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是 、 。

(3)NH3和CO2在一定条件下可合成尿素,其反应为:2NH3(g)+CO2(g) ![]() CO( NH2)2(s)+H2O(g)
CO( NH2)2(s)+H2O(g)
右图表示合成塔中氨碳比a与CO2转化率ω的关系。a为[n(NH3)/n(CO2)],b为水碳比[n(H2O)/n(CO2)]。则:
①b应控制在 ; A.1.5.1.6 B.1~1.1 C.0.6~0.7
②a应控制在4.0的理由是 。
(4)在合成氨的设备(合成塔)中,设置热交换器的目的是 ;在合成硝酸的吸收塔中通入空气的目的是 。
(5)生产硝酸的过程中常会产生一些氮的氧化物,可用如下两种方法处理:
碱液吸收法:NO+NO2+2NaOH=2NaNO2+H2O
NH3还原法:8NH3+6NO2![]() 7N2+12H2O(NO也有类似的反应)
7N2+12H2O(NO也有类似的反应)
以上两种方法中,符合绿色化学的是 。
(6)某化肥厂用NH3制备NH4NO3。已知:由NH3制NO的产率是96%、NO制HNO3的产率是92%,则制HNO3所用去的NH3的质量占总耗NH3质量(不考虑其它损耗)的 %。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为 ;1 mol O22+中含有的π键数目为____________________。
(2)Fe2(SO4)3晶体中铁离子的核外电子排布式为 。
(3)乙醇与乙醛的相对分子质量相差不大,但乙醇的沸点(78.5℃)却比乙醛的沸点(20.8℃)高出许多,其原因是 。
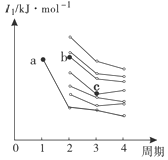
(4)右图是部分主族元素第一电离能梯度图,图中a点对应的元素为氢,b、c两点对应的元素分别为 、 (填元素符号)。
(5)亚硝酸的酸性强于次氯酸的原因为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物阿司匹林可由水杨酸制得,它们的结构如图所示。有关说法正确的是

A.服用阿司匹林,身体出现水杨酸不良反应时,可静脉注射NaHCO3溶液
B.阿司匹林的分子式为C9H10O4
C.1 mol阿司匹林最多可消耗2 mol NaOH
D.水杨酸可以发生取代、加成、氧化、加聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】
A、B、C、D为前四周期元素。A元素的原子价电子排布为ns2np2,B元素原子的最外层电子数是其电子层数的3倍,C元素原子的M能层的p能级有3个未成对电子,D元素原子核外的M能层中只有2对成对电子。请回答下列问题:
(1)当n=2时,AB2属于__________分子(填“极性”或“非极性”),分子中有__________个δ键、__________个π键。A6H6分子中A原子的杂化轨道类型是__________杂化。
(2)当n=3时,A与B形成的晶体属于__________晶体。
(3)若A元素的原子价电子排布为3s23p2,A、C、D三种元素的第一电离能由大到小的顺序是__________(用元素符号表示).
(4)已知某红紫色配合物的组成为CoCl3·5NH3·H2O,该配合物中的中心离子钴离子在基态时的核外电子排布式为____________________。
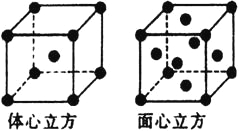
(5)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示,体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现设计如下路线合成有机物E(C6H8O4),(其中A的相对分子质量是56,B的相对分子质量是125)。

(1)烃A的分子式是,D的结构简式为______________;
(2)③的反应类型是____________反应;
(3)已知E为顺式结构,则其结构简式是____________;
(4)下列说法正确的是____________(填序号)
a.反应①属于加成反应
b.B与二氯甲烷互为同系物
c.C存在立体异构体
d.D能使溴水褪色
(5)若C转化为D经过如下4步反应完成:![]() 。
。
则④的化学方程式是____________,⑥所需的无机试剂及反应条件是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
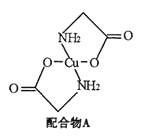
【题目】已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到配合物A。其结构如右图:
(1)Cu元素基态原子的外围电子排布图为 。
(2)配合物A中碳原子的轨道杂化类型为 。
(3)1mol氨基乙酸钠(H2N-CH2-COONa)含有![]() 键的数目为 。
键的数目为 。
(4)氨基乙酸钠分解产物之一为二氧化碳。写出二氧化碳的一种等电子体且为负一价阴离子: (写化学式)。
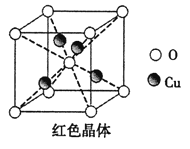
(5)已知:硫酸铜灼烧可以生成一种红色晶体,其结构如图,则该化合物的化学式是 。
(6)配合物A中元素C、H、N、O组成CH4和NO在400~500℃和Pt做催化剂下转化成无毒害物质,利用该反应可以控制机动车尾气排放。该反应方程式为
___________ ________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com