
【题目】物质A-J均是中学化学中常见的物质,其相互关系如图所示,已知A、B、C、D、E和F、G、H、I、J中分别含有相同的某一种元素,J物质颜色是红褐色。请填写下列空白:
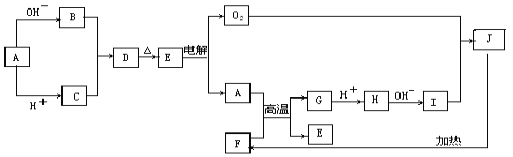
(1)写出A和OH-反应的离子方程式____,
(2)B和C反应的离子方程式____;
(3)写出A和F反应的化学方程式:____;
(4)写出I和O2反应的化学方程式:____。
【答案】2Al+2OH-+2H2O=2AlO2-+3H2↑ Al3++3AlO2-+6H2O=4Al(OH)3↓ 2Al+Fe2O3![]() 2Fe+Al2O3 4Fe(OH)2+O2+2 H2O =4Fe(OH)3
2Fe+Al2O3 4Fe(OH)2+O2+2 H2O =4Fe(OH)3
【解析】
A能和酸反应也能和碱反应,说明A具有两性,且B和C能发生反应生成D,D加热生成E,E电解生成A和氧气,且A到E中都含有同一元素,则这几种物质中都含有铝元素,电解氧化铝生成铝和氧气,则E是Al2O3,A是Al,D是Al(OH)3,B为偏铝酸盐,C是铝盐;J物质颜色是红褐色,则J是Fe(OH)3,Fe(OH)3加热生成F,则F是Fe2O3;H和碱反应生成I,I和氧气反应生成Fe(OH)3,则I是Fe(OH)2;Al与Fe2O3反应生成氧化铝和铁,G是Fe。
根据以上分析,(1)铝和OH-反应生成偏铝酸盐和氢气,反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)铝盐与偏铝酸盐发生反应生成氢氧化铝沉淀,反应的离子方程式为Al3++3AlO2-+6H2O=4Al(OH)3↓;
(3)铝和氧化铁发生铝热反应生成氧化铝和铁,反应的化学方程式是2Al+Fe2O3![]() 2Fe+Al2O3;
2Fe+Al2O3;
(4)Fe(OH)2和O2反应生成Fe(OH)3,反应的化学方程式是4Fe(OH)2+O2+2 H2O =4Fe(OH)3。


科目:高中化学 来源: 题型:
【题目】五种短周期元素A、B、C、D、E的原子序数依次增大。A和C同族,B和D同族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成离子化合物,其阴阳离子个数比为1∶1。回答下列问题:
(1)五种元素中非金属性最强的是____(填元素符号)。
(2)由A和B、D、E所形成的共价化合物中,热稳定性最差的是___(用化学式表示)。
(3)C和E形成的离子化合物的电子式为 __,用电子式表示A和B形成的过程___,A和E形成的化合物与A和B形成的化合物反应,产物的化学式___
(4)D的最高价氧化物的水化物的化学式为____。
(5)由A和B形成的一种气体在工业上用途很广,实验室制取的方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨所需的氢气可用煤和水作原料经过多步反应制得,其中的一步反应为:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H< 0,反应到达平衡后,为提高CO的转化率,下列措施中正确的是( )
CO2(g)+H2(g) △H< 0,反应到达平衡后,为提高CO的转化率,下列措施中正确的是( )
A. 增加压强B. 降低温度或增大H2O(g)的浓度
C. 增大CO的浓度D. 更换催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,将前者和后者混合时,无论前者是否过量,都能用同一个化学方程式表示的是( )
A.![]() 溶液,NaOH溶液B.稀
溶液,NaOH溶液B.稀![]() ,
,![]() 溶液
溶液
C.澄清石灰水,![]() D.氨水,
D.氨水,![]() 溶液
溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4 NH4++6HCHO===3H++6H2O+(CH2)6N4H+ [滴定时,1 mol(CH2)6N4H+与 l mol H+相当],然后用NaOH标准溶液滴定反应生成的酸,某兴趣小组用甲醛法进行了如下实验:
步骤I 称取样品1.500g。
步骤II 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤III 移取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀、静置5 min后,加入1-2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤III填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数______ (填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积______(填“偏大”、“偏小”或“无影响”)
③滴定时边滴边摇动锥形瓶,眼睛应观察____________
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由_______色,且_____________。
(2)滴定结果如下表所示:

若NaOH标准溶液的浓度为0.1010mol·L-1则该样品中氮的质量分数为______
(3)实验室现有3种酸碱指示剂,其pH变色范围如下:
甲基橙:3.1~4.4 石蕊:5.0~8.0 酚酞:8.2~10.0
用0.1000mol/LNaOH溶液滴定未知浓度的CH3COOH溶液,反应恰好完全时,下列叙述中正确的是__________。
A.溶液呈中性,可选用甲基橙或酚酞作指示剂
B.溶液呈中性,只能选用石蕊作指示剂
C.溶液呈碱性,可选用甲基橙或酚酞作指示剂
D.溶液呈碱性,只能选用酚酞作指示剂
(4)在25 ℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式),生成该沉淀的离子方程式为_________。已知25 ℃时Ksp[Mg(OH)2]=1.8×10—11,Ksp[Cu(OH)2]=2.2×10—20。
(5)在25 ℃下,将a mol·L—1的氨水与0.01 mol·L—1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl—),则溶液显_______性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸橙花酯兼有橙花和玫瑰花香气,其结构简式如图。关于该有机物的叙述中正确的是
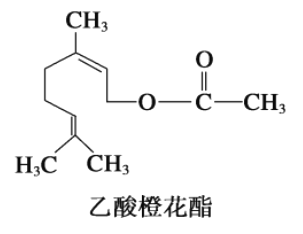
① 在Ni催化条件下1mol该有机物可与3mol H2发生加成;
② 该有机物不能发生银镜反应;
③ 该有机物分子式为C12H22O2;
④ 该有机物的同分异构体中不可能有酚类;
⑤ 1 mol该有机物水解时只能消耗1 mol NaOH
A. ②③④ B. ①④⑤ C. ②④⑤ D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】医学上常将酸性高锰酸钾溶液和草酸溶液的反应用于测定血钙的含量。回答下列问题:__H++__MnO4-+__H2C2O4→__CO2↑+__Mn2++__________
(1)配平以上离子方程式,并在![]() 中填上所需的微粒或数字。
中填上所需的微粒或数字。
(2)该反应中的还原剂是___。
(3)反应转移了0.4mol电子,则消耗KMnO4的物质的量为___mol。
(4)测定血钙的含量的方法是:取2mL血液用蒸馏水稀释后,向其中加入足量(NH4)2C2O4溶液,反应生成CaC2O4沉淀,将沉淀用稀硫酸溶解得到H2C2O4后,再用KMnO4溶液滴定。
①稀硫酸溶解CaC2O4沉淀的化学方程式是__。
②溶解沉淀时__(能或不能)用稀盐酸,原因是___。
③若消耗了1.0×10-4mol/L的KMnO4溶液20.00mL,则100mL该血液中含钙__g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可利用如图所示电解装置吸收和转化![]() (A,B均为惰性电极)。下列说法正确的是( )
(A,B均为惰性电极)。下列说法正确的是( )

A. B电极为电解池的阴极
B. B极区吸收5mo1 ![]() ,则A极区生成2.5mo1
,则A极区生成2.5mo1 ![]()
C. B极区电解液为稀硫酸,电解一段时间后硫酸浓度增大
D. A电极的电极反应为: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是

A. 原子半径:W<X
B. 常温常压下,Y单质为固态
C. 气态氢化物热稳定性:Z<W
D. X的最高价氧化物的水化物是强碱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com