
【题目】催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO。反应的热化学方程式如下:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)ΔH1=-53.7kJ·mol-1 I
CH3OH(g)+H2O(g)ΔH1=-53.7kJ·mol-1 I
CO2(g)+H2(g)![]() CO(g)+H2O(g)ΔH2 II
CO(g)+H2O(g)ΔH2 II
某实验室控制CO2和H2初始投料比为1:2.2,在相同压强下,经过相同反应时间测得如下实验数据:
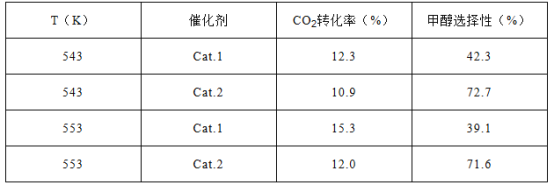
【备注】催化剂.1:Cu/ZnO纳米棒;催化剂.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醇的百分比
已知:①CO和H2的标准燃烧热分别为-283.0kJ·mol-1和-285.8kJ·mol-1
②H2O(l)![]() H2O(g)ΔH3=44.0kJ·mol-1
H2O(g)ΔH3=44.0kJ·mol-1
请回答(不考虑温度对ΔH的影响):
(1)反应I的平衡常数表达式K=_________;反应II的ΔH2=_____________kJ·mol-1。
(2)有利于提高CO2转化为CH3OH平衡转化率的措施有_________________。
A.使用催化剂.1 B.使用催化剂.2 C.降低反应温度
D.投料比不变,增加反应物的浓度 E.增大CO2和H2的初始投料比
(3)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是__________________________。
【答案】 ![]() +41.2 CD 表中数据表明此时反应未达到平衡,不同的催化剂对反应Ⅰ的催化能力不同,因而在该时刻下对甲醇选择性有影响
+41.2 CD 表中数据表明此时反应未达到平衡,不同的催化剂对反应Ⅰ的催化能力不同,因而在该时刻下对甲醇选择性有影响
【解析】试题分析:(1)化学平衡常数是平衡状态时生成物与反应物的浓度(方程式系数幂次方)乘积比;根据盖斯定律计算反应II的ΔH2;(2)根据影响化学平衡移动的因素分析CO2的平衡转化率;(3)表中数据表明此时反应未达到平衡,不同的催化剂对反应Ⅰ的催化能力不同。
解析:(1)化学平衡常数是平衡状态时生成物与反应物的浓度(方程式系数幂次方)乘积比K=![]() ; CO和H2的标准燃烧热分别为-283.0kJ·mol-1和-285.8kJ·mol-1,则
; CO和H2的标准燃烧热分别为-283.0kJ·mol-1和-285.8kJ·mol-1,则
①CO(g)+ ![]() O2(g)= CO2(g)
O2(g)= CO2(g)![]() -283.0kJ·mol-1
-283.0kJ·mol-1
②H2(g)![]() O2(g)= H2O(l)ΔH=-285.8kJ·mol-1
O2(g)= H2O(l)ΔH=-285.8kJ·mol-1
③H2O(l)![]() H2O(g)ΔH3=44.0kJ·mol-1
H2O(g)ΔH3=44.0kJ·mol-1
根据盖斯定律②+③-①得CO2(g)+H2(g)![]() CO(g)+H2O(g)ΔH2=+41.2 kJ·mol-1;(2)催化剂不能使平衡移动,故AB错误。 C.反应放热,降低反应温度,平衡正向移动,CO2平衡转化率增大,故C正确;
CO(g)+H2O(g)ΔH2=+41.2 kJ·mol-1;(2)催化剂不能使平衡移动,故AB错误。 C.反应放热,降低反应温度,平衡正向移动,CO2平衡转化率增大,故C正确;
投料比不变,增加反应物的浓度,压强增大,平衡正向移动,CO2平衡转化率增大,故D正确; 增大CO2和H2的初始投料比,CO2平衡转化率减小,故E错误。
(3)表中数据表明此时反应未达到平衡,不同的催化剂对反应Ⅰ的催化能力不同,因而在该时刻下对甲醇选择性有影响。


科目:高中化学 来源: 题型:
【题目】用铁片与稀硫酸反应时,下列措施不能使产生氢气的速率加快的是
A.加热 B.滴加少量CuSO4溶液
C.不要稀硫酸,改用98%浓硫酸 D.不用铁片,改用铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两烧杯中各盛放有100mL 3molL﹣1的盐酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲:乙=1:2,则加入铝粉的质量为( )
A.5.4g
B.3.6g
C.2.7g
D.1.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的Fe、FeO和Fe3O4的混合物中加入120mL 4molL一1的稀硝酸,恰好使混合物完全溶解,放出0.06mol NO,往所得溶液中加入KSCN溶液,无血红色出现.若用足量的氢气在加热下还原相同质量的原混合物,能得到铁的物质的量为( )
A.0.14mol
B.0.16mol
C.0.21mol
D.0.24mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B,C,D,E为原子序数依次增大的短周期元素.已知A,B,E3种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3.
(1)写出元素的名称:C , D;
(2)写出元素的原子结构图:
A , B , 二者离子半径:(填离子符号).
(3)A,B的最高价氧化物的水化物的碱性>(填化学式,下同)
(4)D,E的气态氢化物的稳定性:> .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2CO3和NaHCO3是两种常见的钠盐.
(1)下列关于Na2CO3和NaHCO3性质的说法中,正确的是
a.常温下,Na2CO3在水中的溶解度比NaHCO3小
b.相同质量的Na2CO3和NaHCO3分别与足量盐酸反应,在相同条件下产生CO2前者多
c.可用Ca(OH)2溶液鉴别Na2CO3溶液和NaHCO3溶液
d.等物质的量的Na2CO3和NaHCO3分别与足量盐酸反应,在相同条件下产生CO2的体积相同
(2)实验室利用如图所示装置进行Na2CO3和NaHCO3热稳定性对比实验.请回答:物质A是 , 写出实验中所发生的化学方程式 . 
(3)若要除去碳酸钠溶液中的少量碳酸氢钠,请用化学方程式表示除杂原理 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:X(g)+2Y(g)![]() 3Z(g) ΔH=-a kJ·mol-1(a>0)。下列说法不正确的是( )
3Z(g) ΔH=-a kJ·mol-1(a>0)。下列说法不正确的是( )
A. 0.1 mol X和0.2 mol Y充分反应生成Z的物质的量一定小于0.3 mol
B. 达到化学平衡状态时,X、Y、Z的浓度不再发生变化
C. 达到化学平衡状态时,反应放出的总热量可达a kJ
D. 升高反应温度,逆反应速率增大、正反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2是一种常用绿色氧化剂,工业上利用电解法制备H2O2的装置如图所示,初始溶液为氢氧化钠溶液:下列说法正确的是( )

A. a为负极
B. 通入空气的电极反应式为O2+2e﹣+2H+═H2O2
C. 电解一段时间后,左侧溶液pH降低
D. 若生成17g双氧水,则有1molH+从左侧向右侧迁移
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com