
【题目】在炽热条件下,将石蜡油分解产生的乙烯通入下列各试管里,装置如图所示。
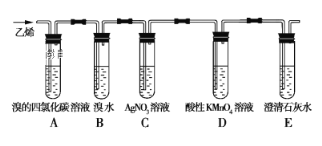
根据上述装置,回答下列问题:
(1)C装置的作用是____________。
(2)已知:1,2-二溴乙烷的密度比水的大,难溶于水,易溶于四氯化碳。预测:A装置中的现象是___________________,B装置中的现象是__________。分离A装置中产物的操作名称是_____,分离B装置中产物需要的玻璃仪器名称是____。
(3)D装置中溶液由紫色变无色,D装置中发生反应的类型为_____。
(4)写出A装置中发生反应的化学方程式_______,反应类型为____,E装置的作用是__________。
【答案】 检验B装置中是否有溴挥发出来 橙色褪去,液体不分层 橙黄色褪去,液体分层 蒸馏 分液漏斗、烧杯、玻璃棒 氧化反应 ![]() 加成反应 检验乙烯与酸性KMnO4溶液反应的产物二氧化碳
加成反应 检验乙烯与酸性KMnO4溶液反应的产物二氧化碳
【解析】
(1)由于溴水易挥发,溴能与硝酸银反应生成溴化银浅黄色沉淀,所以C装置的作用是检验B装置中是否有溴挥发出来。
(2)乙烯与溴发生加成反应生成1,2-二溴乙烷,又因为1,2-二溴乙烷的密度比水的大,难溶于水,易溶于四氯化碳,所以A装置中的现象是橙色褪去,液体不分层;乙烯与溴水发生加成反应,则B装置中的现象是橙黄色褪去,液体分层。1,2-二溴乙烷易溶于四氯化碳,二者的沸点相差较大,则分离A装置中产物的操作名称是蒸馏;1,2-二溴乙烷的密度比水的大,难溶于水,则分离B装置中产物是分液操作,需要的玻璃仪器名称是分液漏斗、烧杯、玻璃棒。
(3)D装置中溶液由紫色变无色,说明酸性高锰酸钾溶液被还原,则D装置中发生反应的类型为氧化反应。
(4)根据以上分析可知A装置中发生反应的化学方程式为CH2=CH2+Br2→CH2BrCH2Br,反应类型为加成反应。二氧化碳能使澄清石灰水变浑浊,则E装置的作用是检验乙烯与酸性KMnO4溶液反应的产物二氧化碳。


科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,又可作为燃料。工业上利用合成气(主要成分为CO、CO2和H2) 在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g) ![]() CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=-58kJ/mol
CH3OH(g)+H2O(g) △H=-58kJ/mol
③CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H=+41kJ/mol
CO(g)+H2O(g) △H=+41kJ/mol
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
化学键 | H-H | C-O | C=O | H-O | C-H |
E/(kJ/mol) | a | b | c | d | x |
则x=______。(用含表中字母的代数式表示)
(2)若将lmolCO2和2molH2充入容积为2L的恒容密闭容器中,在两种不同温度下发生反应②。测得CH3OH的物质的量随时间的变化如图所示。
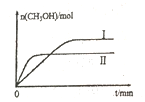
①曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KⅠ_____KⅡ(填“>或“=”或“<”)
②一定温度下,能判断该反应达到化学平衡状态的是______。
a.容器中压强不变
b.甲醇和水蒸气的体积比保持不变
c.v正(H2)=3v逆(CH3OH)
d.2个C=O断裂的同时有3个H-H形成
③若5min后反应达到平衡状态,H2的转化率为90%,则用CO2表示的平均反应速率为_____,该温度下的平衡常数为_____,若容器容积不变,下列措施可增加甲醇产率的是____。
a.升高温度 b.使用合适的催化剂 c.充入He d.按原比例再充入CO2和H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁是目前应用最广泛的金属材料,了解钢铁腐蚀的原因与防护方法具有重要意义,对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命。
(1)抗腐蚀处理前,生产中常用盐酸来除铁锈。现将一表面生锈的铁件放入盐酸中,当铁锈除尽后,溶液中发生的化合反应的化学方程式为__________________。
(2)利用如图装置,可以模拟铁的电化学防护。

①若X为碳棒,为减缓铁件的腐蚀,开关K应置于________________处。
②若X为锌,开关K置于M处,该电化学防护法称为__________。
(3)图中若X为粗铜,容器中海水替换为硫酸铜溶液,开关K置于N处,一段时间后,当铁件质量增加3.2 g时,X电极溶解的铜的质量____3.2 g(填“<”“>”或“=”)。
(4)图中若X为铜,容器中海水替换为FeCl3溶液,开关K置于M处,铜电极发生的反应是______________________,若将开关K置于N处,发生的总反应是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z为原子序数依次增大的短周期主族元素,三种元素属于不同周期。下列转化关系中,A、B、C是X、Y、Z对应的三种气态单质,其余均为常见化合物。下列分析正确的是
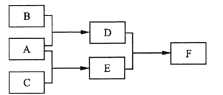
A. Y的氢化物在常温下是液体
B. 与Y同周期氢化物中D最稳定
C. Z的含氧酸均为强酸
D. F含离子键和共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列溶液中,各组离子一定能够大量共存的是( )
A.在强碱性溶液中:Na+、Cl-、SO42-、HCO3-
B.在碳酸钠溶液中:Na+、Cl-、OH-、K+
C.在无色的溶液中:K+、H+、Cl-、MnO4-
D.在强酸性溶液中:Fe2+、Na+、NO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组利用H2还原WO3(黄色)粉末测定W(银白色)的相对原子质量,下图是测定装置的示意图,A中的试剂是盐酸。
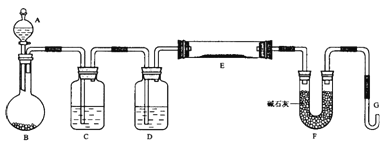
请回答下列问题:
(1)仪器B的名称____________,C中水的作用是_______________________________;
(2)D中盛放的试剂是___________,其作用是___________________________________;
(3)实验过程中有下面几步:①加热反应管E,②从仪器A逐滴滴加液体,③由仪器G收集气体并检验纯度,④待E试管冷却后,停止从A中滴加液体。正确的实验操作顺序是_____;
(4)E中反应的化学方程式_____________________________________________________,
E中产生的现象为___________________________________________________________;
(5)本实验样品WO3为纯净物,且完全被还原。若测得如下数据①空E管的质量a ②E管和WO3的总质量b;③反应后E管和W粉的总质量c(冷却到室温称量);④反应前F管及内盛装物的总质量d;⑤反应后F管及内盛装物的总质量e。由以上数据可以列出计算W的相对原子质量的不同计算式(除W外,其他涉及的元素的相对原子质量均为已知),请写出其中一个。Ar(W)=___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L恒容密闭容器中充入2 mol X和1mol Y发生反应:2X(g)+Y(g) ![]() 3Z(g) ,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是( )
3Z(g) ,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是( )

A. Q点时,Y的转化率最大
B. W点X的正反应速率等于M点X的正反应速率
C. 升高温度,平衡常数增大
D. 温度一定,平衡时充入Z,达到新平衡时Z的体积分数比原平衡时大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.摩尔是国际科学界建议采用的一种物理量
B.国际上规定,0.012 kg碳原子所含有的碳原子数目为1摩尔
C.氢氧化钠的摩尔质量是40g
D.氧气的摩尔质量以g/mol为单位时在数值上等于它的相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:
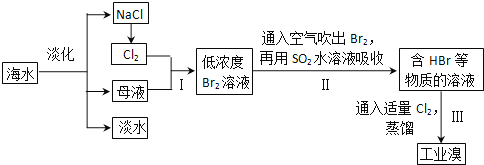
(1)除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序正确的是__________。
A、NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B、BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸
C、NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤后加盐酸
D、Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
(2)步骤I中已获得Br2,步骤II中又将Br2还原为Br一,其目的是富集。发生反应的化学方程式:______________________。
(3)某化学小组的同学为了了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,设计了如下实验装置:
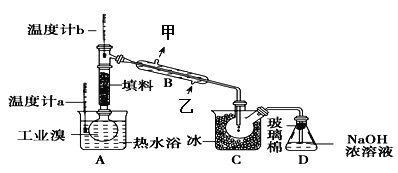
①图中仪器B的名称是______,冷却水的出口为_______(填“甲”或“乙”)。
②D装置的作用是________________。
(4)已知某溶液中Cl一、Br一、I一的物质的量之比为2:3:4,现欲使溶液中的Cl一、Br一、I一的物质的量之比变成4:3:2,那么要通入C12的物质的量是原溶液中I一的物质的量的____________(填选项)。
A、1/2 B、1/3 C、1/4 D、1/6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com