
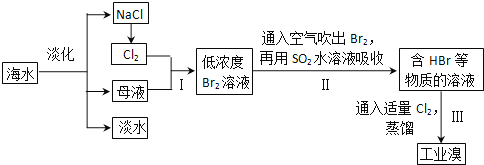
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:
(1)除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序正确的是__________。
A、NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B、BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸
C、NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤后加盐酸
D、Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
(2)步骤I中已获得Br2,步骤II中又将Br2还原为Br一,其目的是富集。发生反应的化学方程式:______________________。
(3)某化学小组的同学为了了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,设计了如下实验装置:
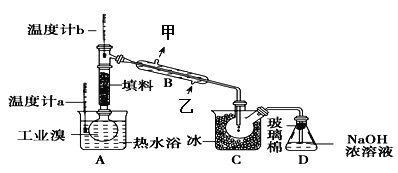
①图中仪器B的名称是______,冷却水的出口为_______(填“甲”或“乙”)。
②D装置的作用是________________。
(4)已知某溶液中Cl一、Br一、I一的物质的量之比为2:3:4,现欲使溶液中的Cl一、Br一、I一的物质的量之比变成4:3:2,那么要通入C12的物质的量是原溶液中I一的物质的量的____________(填选项)。
A、1/2 B、1/3 C、1/4 D、1/6
【答案】 BC Br2+SO2+2H2O===2HBr+H2SO4 冷凝管 甲 吸收尾气 C
【解析】
海水淡化得到氯化钠,电解氯化钠溶液或熔融状态氯化钠会生成氯气,氯气通入母液中发生反应得到低浓度的溴单质溶液,通入热空气吹出后用二氧化硫水溶液吸收得到含HBr的溶液,通入适量氯气氧化得到溴单质,富集溴元素,蒸馏得到工业溴,据此解答。
(1)要先除SO42-离子,然后再除Ca2+离子,碳酸钠可以除去过量的钡离子,如果加反了,过量的钡离子就没法除去,至于加NaOH除去Mg2+离子顺序不受限制,因为过量的氢氧化钠加盐酸就可以调节了,只要将三种离子除完了,然后过滤即可,最后加盐酸除去过量的氢氧根离子、碳酸根离子,则:
A.NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸,最后加入的氯化钡溶液中钡离子不能除去,A错误;
B.BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸,B正确;
C.NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤后加盐酸,C正确;
D.Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸,顺序中加入的氯化钡溶液中钡离子无法除去,D错误;
答案选BC;
(2)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,目的是富集溴元素,步骤Ⅱ中发生反应是二氧化硫吸收溴单质,反应的方程式为Br2+SO2+2H2O=2HBr+H2SO4;
(3)①由装置图可知,提纯溴利用的原理是蒸馏,仪器B为冷凝管,冷凝水应从下端进,即从乙进,冷却水的出口为甲;
②进入D装置的物质为溴蒸汽,溴蒸汽有毒,避免污染环境,最后进行尾气吸收,即D装置的作用是吸收尾气;
(4)已知还原性I->Br->Cl-,反应后I-有剩余,说明Br-浓度没有变化,通入的Cl2只与I-发生反应。设原溶液中含有2molCl-,3molBr-,4molI-,通入Cl2后,它们的物质的量之比变为4:3:2,则各离子物质的量分别为:4molCl-,3molBr-,2molI-,Cl-增加了2mol,则需1molCl2,因此通入的Cl2物质的量是原溶液中I-物质的量的1/4。
答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在炽热条件下,将石蜡油分解产生的乙烯通入下列各试管里,装置如图所示。
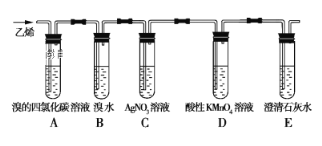
根据上述装置,回答下列问题:
(1)C装置的作用是____________。
(2)已知:1,2-二溴乙烷的密度比水的大,难溶于水,易溶于四氯化碳。预测:A装置中的现象是___________________,B装置中的现象是__________。分离A装置中产物的操作名称是_____,分离B装置中产物需要的玻璃仪器名称是____。
(3)D装置中溶液由紫色变无色,D装置中发生反应的类型为_____。
(4)写出A装置中发生反应的化学方程式_______,反应类型为____,E装置的作用是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用浓盐酸和MnO2制取Cl2的装置如下,某小组欲证明产生的气体中含有HCl。
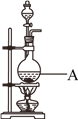
(1)Cl2的电子式是__________,A中反应的离子方程式为____________________。
(2)甲同学将A中产生的气体通入下列溶液:
实验序号 | 试剂 | 现象 |
a | 紫色石蕊溶液 | |
b | AgNO3 | 出现白色沉淀 |
①实验a中的现象为__________。
②不能证明产生的气体中含有HCl的实验是__________(填字母序号)
(3)已知将HCl气体通入饱和食盐水中有白色固体析出。乙同学将A中产生的气体通入饱和食盐水中,有白色固体析出,但实验不能证明气体中含有HCl,结合化学用语解释其原因:_______________________________________________________________________________
(4)已知:2S2O32-+I2=S4O62-+2I-。丙同学将A中产生的气体通入蒸馏水中,得到溶液X,进行以下实验证明气体中含有HCl。
实验I.测定X中溶解的Cl2。取25.00mL溶液X,加入过量KI溶液,然后用0.04mol·L-1Na2S2O3溶液滴定生成的I2,达滴定终点时消耗Na2S2O3溶液VmL。
实验II.测定X中Cl元素重量。另取25.00mL溶液X,选用适当的还原将溶解的Cl2全部还原为Cl-,再用0.10mol·L-1AgNO3溶液滴定说的溶液中的CI-。
①X中的HClO不会影响实验I的测定结果,原因是__________。
②由I、II中实验数据可证明A中产生的气体中含有HCl,则II中0.10mol·L-1AgNO3溶液的体积应大于__________mL(用含V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是常温下某些一元弱酸的电离常数:
弱酸 | HCN | HF | CH3COOH | HNO2 |
电离常数 | 6.2×10-10 | 6.8×10-4 | 1.7×10-5 | 6.4×10-6 |
则0.1 mol·L-1的下列溶液中,pH最小的是( )
A. HCN B. HF C. CH3COOH D. HNO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若甲烷与氯气以1:1混合,在光照下反应得到的产物有
①CH3Cl ②CH2Cl2 ③CHCl3 ④CCl4
A.只有① B.只有③
C.①②③的混合物 D.①②③④的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL 浓度均为0.1mol/L (NH4)2SO4、NH4HSO4混和溶液中滴加0.1mol/L的Ba(OH)2溶液。充分反应后静置,溶液的pH 与所加Ba(OH)2溶液体积的关系如右图,下列说法正确的是
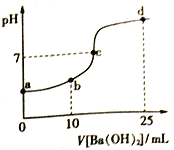
A. a点溶液中: c(NH4+) +c(NH3·H2O)=0.2 mol/L
B. b点溶液中: c(NH4+)>c(SO42-)>c(H+)> c(NH3·H2O)> c(OH-)
C. c点溶液中: c(Ba2+)+ c(NH4+)= c(SO42-)
D. d 点溶液中: c(NH3·H2O)> c(SO42-)>c(NH4+)> c(OH-)> c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素及其化合物在生活及生产中有很多重要用途。
Ⅰ.SiC、BN、GaAs 等是人工合成半导体的材料,具有高温、高频、大功率和抗辐射等优点。请回答:
(1)第一电离能:Ga_______As(填“>”、 “<”、“=”)。
(2)B、C、N的电负性由小到大排列为_______
Ⅱ.卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(1)拟卤素(CN)2、(SCN)2与卤素单质结构相似、性质相近,分子中所有原子都满足 8 电子结构。(SCN)2对应的酸有两种,测得硫氰酸(H—S—C≡N )的沸点低于异硫氰酸(H—N=C=S),其原因是_______。
(2)卤化物 RbICl2在加热时会分解为晶格能相对较大的卤化物 A 和卤素互化物或卤素单质,A 的化学式为_______;I3+属于多卤素阳离子,其空间构型为_______
(3)卤素互化物如IBr、ICl等与卤素单质结构和性质相似。Cl2、IBr、ICl沸点由高到低的顺序为_______。
(4)请推测①HC1O4、②HIO4、③H5IO6[可写成(HO)5IO]三种物质的酸性由强到弱的顺序为_______(填序号)。
(5)CaC2晶体的晶胞结构与 NaCl 晶体的相似(如图所示),CaC2晶体中的哑铃形 C22﹣的存在,使晶胞沿一个方向拉长。此晶体中 1 个 C22﹣周围距离最近的Ca2+为_______个;若该晶胞的边长为a、a、b(pm),则该晶体的密度为_______g·cm-3(写出表达式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物甲、乙用于制备化妆品,二者合成路线如下(部分产物及条件略):

已知:
 (-R、-R'代表烃基或-H)
(-R、-R'代表烃基或-H)
(1)D的结构简式是_______________________。
(2)化合物A能与浓溴水反应产生白色沉淀。
①“E→F”的反应类型是_______________。
②“F→有机化合物甲”的化学方程式是________________________。
③化合物A的结构简式是_________________________。
(3)化合物C的分子式为C3H6O,核磁共振氢谱显示只有一种化学环境的氢。C的结构简式是__________________________。
(4)化合物W的相对分子质量为106,关于B与W的说法,正确的是________________。
a. 互为同系物
b. 可以用酸性KMnO4溶液鉴别
c. 相同物质的量的B和W与H2完全反应,消耗H2物质的量不同
(5)M、N中均只含一种官能团,N中含有四个甲基。X的结构简式是________________。
(6)N的同分异构体在相同的反应条件下也能满足上述合成路线,写出满足上述合成路线的N的同分异构体_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按题目要求答题:
(1)(CH3)2CHCH(CH3)2的系统命名是_________
(2)写出甲苯与浓硫酸、浓硝酸的混合酸在100℃发生取代反应的化学方程式:_____
(3)支链只有一个乙基且相对分子质量最小的烷烃的结构简式________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com