
【题目】下表是常温下某些一元弱酸的电离常数:
弱酸 | HCN | HF | CH3COOH | HNO2 |
电离常数 | 6.2×10-10 | 6.8×10-4 | 1.7×10-5 | 6.4×10-6 |
则0.1 mol·L-1的下列溶液中,pH最小的是( )
A. HCN B. HF C. CH3COOH D. HNO2
 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z为原子序数依次增大的短周期主族元素,三种元素属于不同周期。下列转化关系中,A、B、C是X、Y、Z对应的三种气态单质,其余均为常见化合物。下列分析正确的是
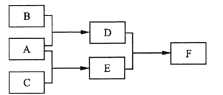
A. Y的氢化物在常温下是液体
B. 与Y同周期氢化物中D最稳定
C. Z的含氧酸均为强酸
D. F含离子键和共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.摩尔是国际科学界建议采用的一种物理量
B.国际上规定,0.012 kg碳原子所含有的碳原子数目为1摩尔
C.氢氧化钠的摩尔质量是40g
D.氧气的摩尔质量以g/mol为单位时在数值上等于它的相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于液氯和氯水的叙述中正确的是( )
A.液氯是纯净物,而氯水是混合物B.液氯和氯水都有酸性
C.液氯和氯水都有漂白性D.液氯无色,氯水呈黄绿色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由硫和亚硫酸钠共热可制备硫代硫酸钠(Na2S2O3),Na2S2O3是重要的化工料,易溶于水,在酸性溶液中发生如下反应:S2O32-+2H+=S↓+SO2↑+H2O。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O),并测定产品的纯度。装置如下(已略去加热装置):

(1)D是尾气处理装置,盛放的溶液可以是__________。
a.酸性高锰酸钾溶液 b.NaOH溶液 c.饱和NaHSO3溶液
(2)C中发生的化学反应有:__________、2Na2S+3SO2=2Na2SO3+3S↓、__________。
(3)经过系列操作,该小组同学从C中制得了Na2S2O3·5H2O,此晶体中可能混有Na2SO3和Na2SO4杂质。接下来,他们做实验证明了则两种杂质的存在,请完成操作:取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,__________,沉淀未完全溶解,并有刺激性气味的气体产生(已知Ba2+与S2O32-不生成沉淀)。
(4)该组同学经讨论认为:先向A中滴加70%的H2SO4,产生的气体将装置中的空气排尽后,再向C加入Na2S和Na2CO3混合溶液,可减少装置C中生成的Na2SO4的量,画出改进后的C装置。___________

(5)测定Na2S2O3·5H2O的纯度:称取Wg产品,用适量蒸馏水溶解,滴加少量淀粉溶液,用0.1000mol·L-1碘的标准溶液滴定,反应原理为2S2O32-+I2=S4O62-+2I-。
①判断反应达到滴定至终点的标志是:______________________________。
②滴定起始和终点的液面位置如图,则产品的纯度为(Na2S2O·5H2O的摩尔质量为Mg·mol-1)____________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:
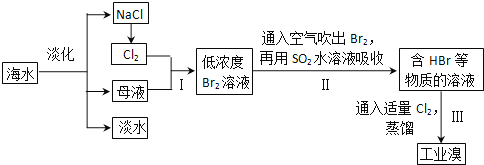
(1)除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序正确的是__________。
A、NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B、BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸
C、NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤后加盐酸
D、Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
(2)步骤I中已获得Br2,步骤II中又将Br2还原为Br一,其目的是富集。发生反应的化学方程式:______________________。
(3)某化学小组的同学为了了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,设计了如下实验装置:
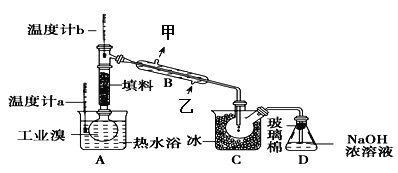
①图中仪器B的名称是______,冷却水的出口为_______(填“甲”或“乙”)。
②D装置的作用是________________。
(4)已知某溶液中Cl一、Br一、I一的物质的量之比为2:3:4,现欲使溶液中的Cl一、Br一、I一的物质的量之比变成4:3:2,那么要通入C12的物质的量是原溶液中I一的物质的量的____________(填选项)。
A、1/2 B、1/3 C、1/4 D、1/6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是现代社会发展的支柱之一。
(1)化学反应中的能量变化,主要表现为热量的变化。
①下列反应中,属于放热反应的是_________(填字母)。
a.Ba(OH)2·8H2O与NH4Cl混合搅拌
b.高温煅烧石灰石
c.铝与盐酸反应
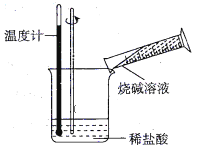
②某同学进行如图所示实验,测量稀盐酸与烧碱溶液中和反应的能量变化。实验表明,反应温度升高;由此判断该反应是_____________(填“吸热”或“放热”)反应,其离子方程式是__________________________。
(2)电能是现代社会应用最广泛的能源之一。如图所示的原电池装置中,负极是____,正极上能够观察到的现象是________,正极的电极反应式是____________。原电池工作一段时间后,若消耗锌6.5 g,则放出气体_______g。
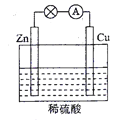
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10mL0.1mol/LNaOH溶液中加入0.1mol/L的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是

A. a点所示溶液中c(A-)+c(HA)=0.1mol/L
B. a、b两点所示溶液中水的电离程度不同
C. pH=7时,c(Na+)=c(A-)
D. b点所示溶液中c(HA)>c(A-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com