
����Ŀ����Դ���ִ���ᷢչ��֧��֮һ��
��1����ѧ��Ӧ�е������仯����Ҫ����Ϊ�����ı仯��
�����з�Ӧ�У����ڷ��ȷ�Ӧ����_________������ĸ����
a��Ba(OH)2��8H2O��NH4Cl��Ͻ���
b����������ʯ��ʯ
c���������ᷴӦ
��ijͬѧ������ͼ��ʾʵ�飬����ϡ�������ռ���Һ�кͷ�Ӧ�������仯��ʵ���������Ӧ�¶����ߣ��ɴ��жϸ÷�Ӧ��_____________��������������������������Ӧ�������ӷ���ʽ��__________________________��
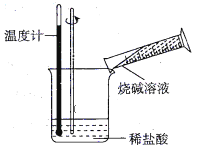
��2���������ִ����Ӧ����㷺����Դ֮һ����ͼ��ʾ��ԭ���װ���У�������____���������ܹ��۲쵽��������________�������ĵ缫��Ӧʽ��____________��ԭ��ع���һ��ʱ���������п6.5 g����ų�����_______g��
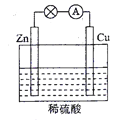
���𰸡� c ���� H++OH����H2O Zn ͭƬ���������ɫ���� 2H++2e����H2�� 0.2
��������
(1)�ٸ��ݳ����ķ��ȷ�Ӧ�У����е�ȼ�ա��������ᷴӦ��������ˮ��Ӧ���кͷ�Ӧ������������Ϸ�Ӧ�����ȷ�Ӧ�ȣ�
���кͷ�Ӧ�Ƿ��ȷ�Ӧ��
(2)���ݽ����Ļ����Ժ�ԭ���ԭ��������п��������������ͭ��������Һ�������ӵõ����ӷ�����ԭ��Ӧ�����������������ĵĽ��������ͷ���ʽ���㡣
(1)��a��Ba��OH��2��8H2O��NH4Cl��Ͻ������ڳ��������ȷ�Ӧ��a����
b��̼��Ƹ��·ֽ�������ƺͶ�����̼�ķ�Ӧ�����ȷ�Ӧ��b����
c���������ᷴӦ�������û���Ӧ������������ԭ��Ӧ����Ӧ�����з��ȣ�c��ȷ��
��ѡc��
���кͷ�Ӧ�Ƿ��ȷ�Ӧ�����ӷ���ʽΪH++OH����H2O��
(2)��Ϊп��ͭ���ã�����п�����������ĵĽ���Ϊп��пʧ��������п���ӽ�����Һ���缫��ӦʽΪZn-2e-��Zn2+��ͭƬ�������ӵõ����������������Ե缫��ӦʽΪ2H++2e����H2����ԭ��ع���һ��ʱ���������п6.5g�����ʵ���n(Zn)=6.5g��65g/mol=0.1mol�����ݷ�ӦZn+2H+��H2��+Zn2+��֪�ų�������Ϊ0.1mol������������Ϊ0.2g��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ��ϡ������Һ�м������������ƹ��壬����ĵ���̶�����
B. ���ʱ��ͨ���Ѵ��ƽ�����Ʒ���������Ʋ����������
C. ��������2NO2(g)=2NO(g)+O2(g)�����Է����У���÷�Ӧ����H>0
D. ��ҵͨ����Ӧ��Na(l)+KCl(l) ![]() NaCl(l)+K(g)��ұ���أ�˵���ƵĽ�����ǿ�ڼ�
NaCl(l)+K(g)��ұ���أ�˵���ƵĽ�����ǿ�ڼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±��dz�����ijЩһԪ����ĵ��볣����
���� | HCN | HF | CH3COOH | HNO2 |
���볣�� | 6.2��10��10 | 6.8��10��4 | 1.7��10��5 | 6.4��10��6 |
��0.1 mol��L��1��������Һ�У�pH��С���ǣ� ��
A. HCN B. HF C. CH3COOH D. HNO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������20mL Ũ�Ⱦ�Ϊ0.1mol/L (NH4)2SO4��NH4HSO4�����Һ�еμ�0.1mol/L��Ba(OH)2��Һ����ַ�Ӧ���ã���Һ��pH ������Ba(OH)2��Һ����Ĺ�ϵ����ͼ������˵����ȷ����
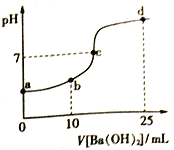
A. a����Һ��: c(NH4+) +c(NH3��H2O)=0.2 mol/L
B. b����Һ��: c(NH4+)>c(SO42-)>c(H+)> c(NH3��H2O)> c(OH-)
C. c����Һ��: c(Ba2+)+ c(NH4+)= c(SO42-)
D. d ����Һ��: c(NH3��H2O)> c(SO42-)>c(NH4+)> c(OH-)> c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�ؼ��仯����������������кܶ���Ҫ��;��
��SiC��BN��GaAs �����˹��ϳɰ뵼��IJ��ϣ����и��¡���Ƶ�����ʺͿ�������ŵ㡣��ش�
��1����һ�����ܣ�Ga_______As���>���� ��<��������������
��2��B��C��N�ĵ縺����С��������Ϊ_______
��±�ػ�ѧ�ḻ��ʣ����γ�±���±�ػ������±����ȶ������͵Ļ����
��1����±��(CN)2��(SCN)2��±�ص��ʽṹ���ơ��������������������ԭ�Ӷ����� 8 ���ӽṹ��(SCN)2��Ӧ���������֣���������ᣨH��S��C��N ���ķе�����������ᣨH��N=C=S������ԭ����_______��
��2��±���� RbICl2�ڼ���ʱ��ֽ�Ϊ��������Խϴ��±���� A ��±�ػ������±�ص��ʣ�A �Ļ�ѧʽΪ_______��I3+���ڶ�±�������ӣ���ռ乹��Ϊ_______
��3��±�ػ�������IBr��ICl����±�ص��ʽṹ���������ơ�Cl2��IBr��ICl�е��ɸߵ��͵�˳��Ϊ_______��
��4�����Ʋ��HC1O4����HIO4����H5IO6[��д��(HO)5IO]�������ʵ�������ǿ������˳��Ϊ_______(�����)��
��5��CaC2����ľ����ṹ�� NaCl ��������ƣ���ͼ��ʾ����CaC2�����е������� C22���Ĵ��ڣ�ʹ������һ�������������˾����� 1 �� C22����Χ���������Ca2+Ϊ_______�������þ����ı߳�Ϊa��a��b��pm������þ�����ܶ�Ϊ_______g��cm-3��д������ʽ����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��3��5-����������������Ҫ���л��ϳ��м��壬��������Ȼ���ʰ������صĺϳɡ�һ���Լ䱽����Ϊԭ�ϵĺϳɷ�Ӧ���£�

��Ӧ�������ȷ�����״����ټ������ѣ�����õ��л��㣨�������Ȼ��⣩����ϴ�ӣ�Ȼ������ᴿ�õ�����״���3��5-�����������ӵIJ����������ʼ��±�������˵����ȷ����
���� | �е�/�� | �۵�/�� | �ܽ��� |
�״� | 64. 7 | ��97.8 | ������ˮ |
3��5-������������ | 172~175 | 33~36 | �����ڼ״������ѣ�����ˮ |
A. �����ϳɷ�Ӧ����ȡ����Ӧ
B. �䱽�����뱽�ӻ�Ϊͬϵ��
C. ������״��IJ����ǽᾧ
D. ϴ��ʱ�����ñ���Na2CO3��Һ���Ȼ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л�������ס��������Ʊ���ױƷ�����ߺϳ�·�����£����ֲ��P�����ԣ���

��֪��
 ��-R��-R'����������-H��
��-R��-R'����������-H��
��1��D�Ľṹ��ʽ��_______________________��
��2��������A����Ũ��ˮ��Ӧ������ɫ������
�١�E��F���ķ�Ӧ������_______________��
�ڡ�F���л�������ס��Ļ�ѧ����ʽ��________________________��
�ۻ�����A�Ľṹ��ʽ��_________________________��
��3��������C�ķ���ʽΪC3H6O���˴Ź���������ʾֻ��һ�ֻ�ѧ�������⡣C�Ľṹ��ʽ��__________________________��
��4��������W����Է�������Ϊ106������B��W��˵������ȷ����________________��
a. ��Ϊͬϵ��
b. ����������KMnO4��Һ����
c. ��ͬ���ʵ�����B��W��H2��ȫ��Ӧ������H2���ʵ�����ͬ
��5��M��N�о�ֻ��һ�ֹ����ţ�N�к����ĸ�����X�Ľṹ��ʽ��________________��
��6��N��ͬ���칹������ͬ�ķ�Ӧ������Ҳ�����������ϳ�·�ߣ�д�����������ϳ�·�ߵ�N��ͬ���칹��_________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�����SO42�����Լ��ǣ� ��
A.BaCl2��ϡ����
B.AgNO3��ϡ����
C.ϡ���ᡢBaCl2
D.AgNO3��ϡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������̼���ƾ���(Na2CO3��10H2O)������1.0 mol��L��1Na2CO3��Һ500 mL����������������ȷ�����������������������ҺŨ��ƫ�ߵ���( )
A. ��ȡ̼���ƾ���53.0 g
B. ����ʱ�����ӹ۲�̶���
C. ��Һʱ���������ܽ�̼���ƾ�����ձ�û�н��г�ϴ
D. ���ݺ�����ƿ��ҡ�ȣ�����ʱ����Һ����ڿ̶��ߣ������ּ�������ˮ���̶���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com