
【题目】常温下,向20mL 浓度均为0.1mol/L (NH4)2SO4、NH4HSO4混和溶液中滴加0.1mol/L的Ba(OH)2溶液。充分反应后静置,溶液的pH 与所加Ba(OH)2溶液体积的关系如右图,下列说法正确的是
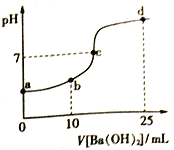
A. a点溶液中: c(NH4+) +c(NH3·H2O)=0.2 mol/L
B. b点溶液中: c(NH4+)>c(SO42-)>c(H+)> c(NH3·H2O)> c(OH-)
C. c点溶液中: c(Ba2+)+ c(NH4+)= c(SO42-)
D. d 点溶液中: c(NH3·H2O)> c(SO42-)>c(NH4+)> c(OH-)> c(H+)
【答案】B
【解析】A. 根据物料守恒可知,a点溶液中:c(NH4+)+c(NH3·H2O)=0. 3mol/L,选项A错误;B、b点溶液中:NH4HSO4与Ba(OH)2溶液反应:2NH4HSO4+Ba(OH)2=2H2O+(NH4)2SO4+ BaSO4↓,故溶液相当于![]() (NH4)2SO4溶液,溶液水解呈酸性,则c(NH4+)>c(SO42-)>c(H+)> c(NH3·H2O)>c(OH-),选项B正确;C、c点溶液中pH=7,c(H+)=c(OH-),根据电荷守恒有2c(Ba2+)+ c(NH4+)+ c(H+)=c(OH-)+2c(SO42-),则:2c(Ba2+)+ c(NH4+)= 2c(SO42-),选项C错误;D、根据所加溶液体积可知,若不考虑生成的氨水的电离和铵根离子的水解,得到的溶液中生成的一水合氨和铵根离子1:1,但溶液呈碱性,故电离大于水解,故c(NH4+)> c(NH3·H2O),选项D错误。答案选择B。
(NH4)2SO4溶液,溶液水解呈酸性,则c(NH4+)>c(SO42-)>c(H+)> c(NH3·H2O)>c(OH-),选项B正确;C、c点溶液中pH=7,c(H+)=c(OH-),根据电荷守恒有2c(Ba2+)+ c(NH4+)+ c(H+)=c(OH-)+2c(SO42-),则:2c(Ba2+)+ c(NH4+)= 2c(SO42-),选项C错误;D、根据所加溶液体积可知,若不考虑生成的氨水的电离和铵根离子的水解,得到的溶液中生成的一水合氨和铵根离子1:1,但溶液呈碱性,故电离大于水解,故c(NH4+)> c(NH3·H2O),选项D错误。答案选择B。


科目:高中化学 来源: 题型:
【题目】某课外小组利用H2还原WO3(黄色)粉末测定W(银白色)的相对原子质量,下图是测定装置的示意图,A中的试剂是盐酸。
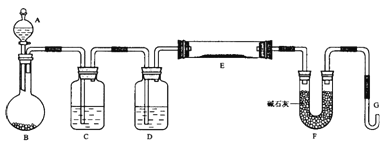
请回答下列问题:
(1)仪器B的名称____________,C中水的作用是_______________________________;
(2)D中盛放的试剂是___________,其作用是___________________________________;
(3)实验过程中有下面几步:①加热反应管E,②从仪器A逐滴滴加液体,③由仪器G收集气体并检验纯度,④待E试管冷却后,停止从A中滴加液体。正确的实验操作顺序是_____;
(4)E中反应的化学方程式_____________________________________________________,
E中产生的现象为___________________________________________________________;
(5)本实验样品WO3为纯净物,且完全被还原。若测得如下数据①空E管的质量a ②E管和WO3的总质量b;③反应后E管和W粉的总质量c(冷却到室温称量);④反应前F管及内盛装物的总质量d;⑤反应后F管及内盛装物的总质量e。由以上数据可以列出计算W的相对原子质量的不同计算式(除W外,其他涉及的元素的相对原子质量均为已知),请写出其中一个。Ar(W)=___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于液氯和氯水的叙述中正确的是( )
A.液氯是纯净物,而氯水是混合物B.液氯和氯水都有酸性
C.液氯和氯水都有漂白性D.液氯无色,氯水呈黄绿色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:
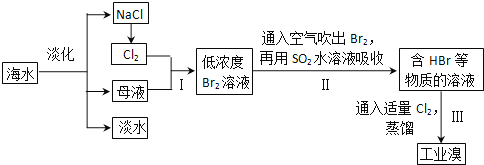
(1)除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序正确的是__________。
A、NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B、BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸
C、NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤后加盐酸
D、Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
(2)步骤I中已获得Br2,步骤II中又将Br2还原为Br一,其目的是富集。发生反应的化学方程式:______________________。
(3)某化学小组的同学为了了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,设计了如下实验装置:
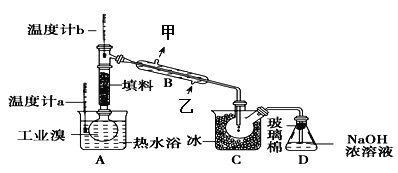
①图中仪器B的名称是______,冷却水的出口为_______(填“甲”或“乙”)。
②D装置的作用是________________。
(4)已知某溶液中Cl一、Br一、I一的物质的量之比为2:3:4,现欲使溶液中的Cl一、Br一、I一的物质的量之比变成4:3:2,那么要通入C12的物质的量是原溶液中I一的物质的量的____________(填选项)。
A、1/2 B、1/3 C、1/4 D、1/6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将物质的量均为amol的FeCl3和CuCl2投人水中形成混合溶液,再加入bmol铁粉充分反应(忽略离子的水解),下列说法中不正确的是
A. 当b≥![]() 时,发生总反应的离子方程式为2Fe3++Cu2++2Fe=4Fe2++Cu
时,发生总反应的离子方程式为2Fe3++Cu2++2Fe=4Fe2++Cu
B. 当![]() <b<
<b<![]() 时,反应中转移电子的物质的量:amol<n(e-)<3amol
时,反应中转移电子的物质的量:amol<n(e-)<3amol
C. 当b≤![]() 时,发生的离子反应为2Fe3++Fe=3Fe2+
时,发生的离子反应为2Fe3++Fe=3Fe2+
D. 当![]() <b<
<b<![]() 元时,反应后的溶液中n(Cu2+):n(Fe2+)=(
元时,反应后的溶液中n(Cu2+):n(Fe2+)=(![]() -b):(b+a)
-b):(b+a)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是现代社会发展的支柱之一。
(1)化学反应中的能量变化,主要表现为热量的变化。
①下列反应中,属于放热反应的是_________(填字母)。
a.Ba(OH)2·8H2O与NH4Cl混合搅拌
b.高温煅烧石灰石
c.铝与盐酸反应
②某同学进行如图所示实验,测量稀盐酸与烧碱溶液中和反应的能量变化。实验表明,反应温度升高;由此判断该反应是_____________(填“吸热”或“放热”)反应,其离子方程式是__________________________。
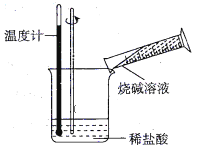
(2)电能是现代社会应用最广泛的能源之一。如图所示的原电池装置中,负极是____,正极上能够观察到的现象是________,正极的电极反应式是____________。原电池工作一段时间后,若消耗锌6.5 g,则放出气体_______g。
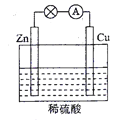
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】顺丁橡胶、制备醇酸树脂的原料M以及杀菌剂N的合成路线如下:

已知:

(1)CH2=CH-CH=CH2的名称是___________________________。
(2)反应Ⅰ的反应类型是______________________(选填字母)。
a. 加聚反应 b. 缩聚反应
(3)顺式聚合物P的结构式是__________________(选填字母)。
a.  b.
b.  c.
c. 
(4)A的相对分子质量为108。
① 反应Ⅱ的化学方程式是_____________________________________。
② 1 mol B完全转化成M所消耗H2的质量是___________g。
(5)反应Ⅲ的化学方程式是__________________________________________。
(6)A的某些同分异构体在相同的反应条件下也能生成B和C。写出其中一种同分异构体的结构简式___________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com