
【题目】由硫和亚硫酸钠共热可制备硫代硫酸钠(Na2S2O3),Na2S2O3是重要的化工料,易溶于水,在酸性溶液中发生如下反应:S2O32-+2H+=S↓+SO2↑+H2O。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O),并测定产品的纯度。装置如下(已略去加热装置):

(1)D是尾气处理装置,盛放的溶液可以是__________。
a.酸性高锰酸钾溶液 b.NaOH溶液 c.饱和NaHSO3溶液
(2)C中发生的化学反应有:__________、2Na2S+3SO2=2Na2SO3+3S↓、__________。
(3)经过系列操作,该小组同学从C中制得了Na2S2O3·5H2O,此晶体中可能混有Na2SO3和Na2SO4杂质。接下来,他们做实验证明了则两种杂质的存在,请完成操作:取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,__________,沉淀未完全溶解,并有刺激性气味的气体产生(已知Ba2+与S2O32-不生成沉淀)。
(4)该组同学经讨论认为:先向A中滴加70%的H2SO4,产生的气体将装置中的空气排尽后,再向C加入Na2S和Na2CO3混合溶液,可减少装置C中生成的Na2SO4的量,画出改进后的C装置。___________

(5)测定Na2S2O3·5H2O的纯度:称取Wg产品,用适量蒸馏水溶解,滴加少量淀粉溶液,用0.1000mol·L-1碘的标准溶液滴定,反应原理为2S2O32-+I2=S4O62-+2I-。
①判断反应达到滴定至终点的标志是:______________________________。
②滴定起始和终点的液面位置如图,则产品的纯度为(Na2S2O·5H2O的摩尔质量为Mg·mol-1)____________________。

【答案】 ab Na2CO3+SO2=CO2+Na2SO3 Na2SO3+S![]() Na2S2O3。 过滤后用蒸馏水洗涤沉淀,向沉淀中加入足量稀盐酸
Na2S2O3。 过滤后用蒸馏水洗涤沉淀,向沉淀中加入足量稀盐酸 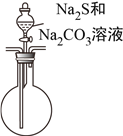 最后一滴碘液滴入时,溶液由无色变蓝色,且30s内不恢复原来的颜色
最后一滴碘液滴入时,溶液由无色变蓝色,且30s内不恢复原来的颜色 ![]() ×100%。
×100%。
【解析】本题考查实验方案设计与评价,(1)SO2是有毒气体,防止污染空气,需要进行尾气处理,利用SO2属于酸性氧化物或具有还原性,进行除去,a、酸性高锰酸钾溶液氧化SO2为SO42-,故a正确;b、SO2与NaOH反应生成Na2SO3,故b正确;c、SO2与NaHSO3不发生反应,不能除去SO2,故c错误;(2)亚硫酸的酸性强于碳酸,因此发生SO2+Na2CO3=Na2SO3+CO2,反应制备硫代硫酸钠晶体,因此发生Na2SO3+S ![]() Na2S2O3;;(3)实验证明两种杂质的存在,因为S2O32-与Ba2+不生成沉淀,但S2O32-与H+反应生成S和SO2,因此滴加BaCl2溶液有白色沉淀生成后,应过滤,排除S2O32-的干扰,然后向沉淀中加入足量的稀盐酸,沉淀未完全溶解,说明沉淀中有BaSO4,即杂质中含有Na2SO4,由刺激性气味气体产生,此气体为SO2,说明杂质中含有Na2SO3;(4)根据信息,需要先排除装置中空气,防止干扰实验,再向C中加入硫化钠和碳酸钠溶液,因此装置设计成
Na2S2O3;;(3)实验证明两种杂质的存在,因为S2O32-与Ba2+不生成沉淀,但S2O32-与H+反应生成S和SO2,因此滴加BaCl2溶液有白色沉淀生成后,应过滤,排除S2O32-的干扰,然后向沉淀中加入足量的稀盐酸,沉淀未完全溶解,说明沉淀中有BaSO4,即杂质中含有Na2SO4,由刺激性气味气体产生,此气体为SO2,说明杂质中含有Na2SO3;(4)根据信息,需要先排除装置中空气,防止干扰实验,再向C中加入硫化钠和碳酸钠溶液,因此装置设计成 ;(5)①淀粉遇到碘单质变蓝,根据反应原理,滴定至终点的标志为:最后一滴碘液滴入时,溶液由无色变蓝色,且30s内不恢复原来的颜色;②滴定中消耗I2的体积为18.10mL,根据2S2O32-+I2=S4O62-+2I-,n(Na2SO3·5H2O)=2×18.10×10-3×0.1mol,纯度为2×18.10×10-3×0.1×M/W×100%=
;(5)①淀粉遇到碘单质变蓝,根据反应原理,滴定至终点的标志为:最后一滴碘液滴入时,溶液由无色变蓝色,且30s内不恢复原来的颜色;②滴定中消耗I2的体积为18.10mL,根据2S2O32-+I2=S4O62-+2I-,n(Na2SO3·5H2O)=2×18.10×10-3×0.1mol,纯度为2×18.10×10-3×0.1×M/W×100%= ![]() ×100%。
×100%。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】(15分)某实验小组同学对电化学原理进行了一系列探究活动。

(1)右图为某实验小组依据氧化还原反应:(用离子方程式表示) 设计的原电池装置,一段时间后,两电极质量相差12g,导线中通过 mol电子。
(2)其它条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为 ,这是由于NH4Cl溶液显 性,(填酸性、碱性或中性)用离子方程式表示溶液显此性的原因 ,用吸管吸出铁片附近溶液少许至于试管中,向其中滴加少量新制饱和氯水,写出发生反应的离子方程式 ,然后滴加几滴硫氰化钾溶液,溶液变红,继续滴加过量新制饱和氯水,颜色褪去,同学们对此做了多种假设,某同学的假设是:溶液中的+3价铁被氧化为更高的价态。”如果+3价铁被氧化为FeO42-,试写出该反应的离子方程式 。
(3)如图其它条件不变,若将盐桥换成弯铜导线与石墨相连成n型,如图所示,一段时间后,在甲装置铜丝附近滴加酚酞试液,现象是 ,电极反应为 ;乙装置中石墨(1)为 极(填正、负、阴、阳),乙装置中与铜线相连石墨电极上发生的反应式为 ,产物常用 检验,反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用金属活泼性的差异,可以采取不同的冶炼方法冶炼金属。下列化学反应原理在金属冶炼工业中还没有得到应用的是( )
A. Al2O3+3C![]() 2Al+3CO↑ B. Fe2O3+3CO
2Al+3CO↑ B. Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
C. 2Ag2O![]() 4Ag+O2↑ D. Fe2O3+2Al
4Ag+O2↑ D. Fe2O3+2Al![]() 2Fe+Al2O3
2Fe+Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用浓盐酸和MnO2制取Cl2的装置如下,某小组欲证明产生的气体中含有HCl。
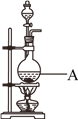
(1)Cl2的电子式是__________,A中反应的离子方程式为____________________。
(2)甲同学将A中产生的气体通入下列溶液:
实验序号 | 试剂 | 现象 |
a | 紫色石蕊溶液 | |
b | AgNO3 | 出现白色沉淀 |
①实验a中的现象为__________。
②不能证明产生的气体中含有HCl的实验是__________(填字母序号)
(3)已知将HCl气体通入饱和食盐水中有白色固体析出。乙同学将A中产生的气体通入饱和食盐水中,有白色固体析出,但实验不能证明气体中含有HCl,结合化学用语解释其原因:_______________________________________________________________________________
(4)已知:2S2O32-+I2=S4O62-+2I-。丙同学将A中产生的气体通入蒸馏水中,得到溶液X,进行以下实验证明气体中含有HCl。
实验I.测定X中溶解的Cl2。取25.00mL溶液X,加入过量KI溶液,然后用0.04mol·L-1Na2S2O3溶液滴定生成的I2,达滴定终点时消耗Na2S2O3溶液VmL。
实验II.测定X中Cl元素重量。另取25.00mL溶液X,选用适当的还原将溶解的Cl2全部还原为Cl-,再用0.10mol·L-1AgNO3溶液滴定说的溶液中的CI-。
①X中的HClO不会影响实验I的测定结果,原因是__________。
②由I、II中实验数据可证明A中产生的气体中含有HCl,则II中0.10mol·L-1AgNO3溶液的体积应大于__________mL(用含V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是常温下某些一元弱酸的电离常数:
弱酸 | HCN | HF | CH3COOH | HNO2 |
电离常数 | 6.2×10-10 | 6.8×10-4 | 1.7×10-5 | 6.4×10-6 |
则0.1 mol·L-1的下列溶液中,pH最小的是( )
A. HCN B. HF C. CH3COOH D. HNO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若甲烷与氯气以1:1混合,在光照下反应得到的产物有
①CH3Cl ②CH2Cl2 ③CHCl3 ④CCl4
A.只有① B.只有③
C.①②③的混合物 D.①②③④的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素及其化合物在生活及生产中有很多重要用途。
Ⅰ.SiC、BN、GaAs 等是人工合成半导体的材料,具有高温、高频、大功率和抗辐射等优点。请回答:
(1)第一电离能:Ga_______As(填“>”、 “<”、“=”)。
(2)B、C、N的电负性由小到大排列为_______
Ⅱ.卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(1)拟卤素(CN)2、(SCN)2与卤素单质结构相似、性质相近,分子中所有原子都满足 8 电子结构。(SCN)2对应的酸有两种,测得硫氰酸(H—S—C≡N )的沸点低于异硫氰酸(H—N=C=S),其原因是_______。
(2)卤化物 RbICl2在加热时会分解为晶格能相对较大的卤化物 A 和卤素互化物或卤素单质,A 的化学式为_______;I3+属于多卤素阳离子,其空间构型为_______
(3)卤素互化物如IBr、ICl等与卤素单质结构和性质相似。Cl2、IBr、ICl沸点由高到低的顺序为_______。
(4)请推测①HC1O4、②HIO4、③H5IO6[可写成(HO)5IO]三种物质的酸性由强到弱的顺序为_______(填序号)。
(5)CaC2晶体的晶胞结构与 NaCl 晶体的相似(如图所示),CaC2晶体中的哑铃形 C22﹣的存在,使晶胞沿一个方向拉长。此晶体中 1 个 C22﹣周围距离最近的Ca2+为_______个;若该晶胞的边长为a、a、b(pm),则该晶体的密度为_______g·cm-3(写出表达式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增加。K、L、M、N均是由这些元素组成的二元化合物,甲、乙分别是元素X、Y的单质,甲是固体,乙是气体,K是主要的大气污染物之一,0.05mol·L-1丙溶液的pH为1,上述物质的转化关系如下图所示。下列说法正确的是( )

A. 原子半径:W<X<Y<Z B. 元素的非金属性:Y>Z>X
C. 原子最外层电子数:W<X<Y<Z D. K、L、M、N四种物质中沸点最高的是N
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com