
【题目】用浓盐酸和MnO2制取Cl2的装置如下,某小组欲证明产生的气体中含有HCl。
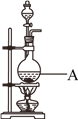
(1)Cl2的电子式是__________,A中反应的离子方程式为____________________。
(2)甲同学将A中产生的气体通入下列溶液:
实验序号 | 试剂 | 现象 |
a | 紫色石蕊溶液 | |
b | AgNO3 | 出现白色沉淀 |
①实验a中的现象为__________。
②不能证明产生的气体中含有HCl的实验是__________(填字母序号)
(3)已知将HCl气体通入饱和食盐水中有白色固体析出。乙同学将A中产生的气体通入饱和食盐水中,有白色固体析出,但实验不能证明气体中含有HCl,结合化学用语解释其原因:_______________________________________________________________________________
(4)已知:2S2O32-+I2=S4O62-+2I-。丙同学将A中产生的气体通入蒸馏水中,得到溶液X,进行以下实验证明气体中含有HCl。
实验I.测定X中溶解的Cl2。取25.00mL溶液X,加入过量KI溶液,然后用0.04mol·L-1Na2S2O3溶液滴定生成的I2,达滴定终点时消耗Na2S2O3溶液VmL。
实验II.测定X中Cl元素重量。另取25.00mL溶液X,选用适当的还原将溶解的Cl2全部还原为Cl-,再用0.10mol·L-1AgNO3溶液滴定说的溶液中的CI-。
①X中的HClO不会影响实验I的测定结果,原因是__________。
②由I、II中实验数据可证明A中产生的气体中含有HCl,则II中0.10mol·L-1AgNO3溶液的体积应大于__________mL(用含V的代数式表示)。
【答案】 ![]() MnO2+4H++2Cl-
MnO2+4H++2Cl- ![]() Cl2↑+2H2O+Mn2+ 溶液先变红再褪色 a、b Cl2+H2O
Cl2↑+2H2O+Mn2+ 溶液先变红再褪色 a、b Cl2+H2O![]() HCl+HClO,Cl2溶于水后使得溶液中的c(CI-)增大,也能析出晶体 生成1molHClO需消耗1molCl2,HClO也有氧化性,1molHClO和1molCl2均能将2molKI氧化成I2或者Cl2+H2O
HCl+HClO,Cl2溶于水后使得溶液中的c(CI-)增大,也能析出晶体 生成1molHClO需消耗1molCl2,HClO也有氧化性,1molHClO和1molCl2均能将2molKI氧化成I2或者Cl2+H2O![]() HCl+HClO,Cl2发生反应时,上述平衡逆向移动,相当于Cl2全部参与氧化I-的反应 0.4V
HCl+HClO,Cl2发生反应时,上述平衡逆向移动,相当于Cl2全部参与氧化I-的反应 0.4V
【解析】(1)Cl2的电子式是![]() ,二氧化锰与浓盐酸加热制备氯气的离子方程式为:MnO2+4H++2Cl-
,二氧化锰与浓盐酸加热制备氯气的离子方程式为:MnO2+4H++2Cl- ![]() Cl2↑+2H2O+Mn2+。(2)①因氯水既有酸性又强氧化性,能漂白有机色质,将氯气通入紫色蕊溶液中可以看到溶液先变红再褪色;②因浓盐酸有挥发性,将混有氯化氢的氯气通入硝酸银溶液,生成氯化银沉淀,其中氯离子可来自氯水或氯化氢中,故实验a、b均不能说明产生的气体中含有HCl;(3)氯气与水反应的平衡方程式为:Cl2+H2O
Cl2↑+2H2O+Mn2+。(2)①因氯水既有酸性又强氧化性,能漂白有机色质,将氯气通入紫色蕊溶液中可以看到溶液先变红再褪色;②因浓盐酸有挥发性,将混有氯化氢的氯气通入硝酸银溶液,生成氯化银沉淀,其中氯离子可来自氯水或氯化氢中,故实验a、b均不能说明产生的气体中含有HCl;(3)氯气与水反应的平衡方程式为:Cl2+H2O![]() HCl+HClO,Cl2溶于水后使得溶液中的c(Cl-)增大,也能析出晶体;(4)①生成1molHClO需消耗1molCl2,HClO也有氧化性,1molHClO和1molCl2均能将2molKI氧化成I2或者Cl2+H2O
HCl+HClO,Cl2溶于水后使得溶液中的c(Cl-)增大,也能析出晶体;(4)①生成1molHClO需消耗1molCl2,HClO也有氧化性,1molHClO和1molCl2均能将2molKI氧化成I2或者Cl2+H2O![]() HCl+HClO,Cl2发生反应时,上述平衡逆向移动,相当于Cl2全部参与氧化I-的反应;② 由关系式:Cl2——I2——2S2O32-——2Cl-;n(Cl-)=n(S2O32-)=n(AgNO3)= VmL×10-3×0.04mol·L-1,v(AgNO3)= n(AgNO3)/c(AgNO3)=( VmL×10-3×0.04mol·L-1/0.10mol·L-1)×103=0.4VmL。
HCl+HClO,Cl2发生反应时,上述平衡逆向移动,相当于Cl2全部参与氧化I-的反应;② 由关系式:Cl2——I2——2S2O32-——2Cl-;n(Cl-)=n(S2O32-)=n(AgNO3)= VmL×10-3×0.04mol·L-1,v(AgNO3)= n(AgNO3)/c(AgNO3)=( VmL×10-3×0.04mol·L-1/0.10mol·L-1)×103=0.4VmL。


 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
【题目】钢铁是目前应用最广泛的金属材料,了解钢铁腐蚀的原因与防护方法具有重要意义,对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命。
(1)抗腐蚀处理前,生产中常用盐酸来除铁锈。现将一表面生锈的铁件放入盐酸中,当铁锈除尽后,溶液中发生的化合反应的化学方程式为__________________。
(2)利用如图装置,可以模拟铁的电化学防护。

①若X为碳棒,为减缓铁件的腐蚀,开关K应置于________________处。
②若X为锌,开关K置于M处,该电化学防护法称为__________。
(3)图中若X为粗铜,容器中海水替换为硫酸铜溶液,开关K置于N处,一段时间后,当铁件质量增加3.2 g时,X电极溶解的铜的质量____3.2 g(填“<”“>”或“=”)。
(4)图中若X为铜,容器中海水替换为FeCl3溶液,开关K置于M处,铜电极发生的反应是______________________,若将开关K置于N处,发生的总反应是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L恒容密闭容器中充入2 mol X和1mol Y发生反应:2X(g)+Y(g) ![]() 3Z(g) ,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是( )
3Z(g) ,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是( )

A. Q点时,Y的转化率最大
B. W点X的正反应速率等于M点X的正反应速率
C. 升高温度,平衡常数增大
D. 温度一定,平衡时充入Z,达到新平衡时Z的体积分数比原平衡时大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.摩尔是国际科学界建议采用的一种物理量
B.国际上规定,0.012 kg碳原子所含有的碳原子数目为1摩尔
C.氢氧化钠的摩尔质量是40g
D.氧气的摩尔质量以g/mol为单位时在数值上等于它的相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 氯化铵溶液,加水稀释时,c(NH4+)/c(Cl-)的值一定减小
B. 0.1 mol·L-1的盐酸和0.1 mol·L-1的弱酸HA溶液分别加水稀释10倍:pH(HA) > pH(盐酸)
C. 已知25℃时,HA的Ka=6.25×10—5,当pH为5.0时,HA溶液中 = 0.16
= 0.16
D. 某二元酸的酸式盐NaHA溶液中必然存在:c(H+)+c(A2—)=c(OH—)+c(H2A)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于液氯和氯水的叙述中正确的是( )
A.液氯是纯净物,而氯水是混合物B.液氯和氯水都有酸性
C.液氯和氯水都有漂白性D.液氯无色,氯水呈黄绿色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由硫和亚硫酸钠共热可制备硫代硫酸钠(Na2S2O3),Na2S2O3是重要的化工料,易溶于水,在酸性溶液中发生如下反应:S2O32-+2H+=S↓+SO2↑+H2O。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O),并测定产品的纯度。装置如下(已略去加热装置):

(1)D是尾气处理装置,盛放的溶液可以是__________。
a.酸性高锰酸钾溶液 b.NaOH溶液 c.饱和NaHSO3溶液
(2)C中发生的化学反应有:__________、2Na2S+3SO2=2Na2SO3+3S↓、__________。
(3)经过系列操作,该小组同学从C中制得了Na2S2O3·5H2O,此晶体中可能混有Na2SO3和Na2SO4杂质。接下来,他们做实验证明了则两种杂质的存在,请完成操作:取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,__________,沉淀未完全溶解,并有刺激性气味的气体产生(已知Ba2+与S2O32-不生成沉淀)。
(4)该组同学经讨论认为:先向A中滴加70%的H2SO4,产生的气体将装置中的空气排尽后,再向C加入Na2S和Na2CO3混合溶液,可减少装置C中生成的Na2SO4的量,画出改进后的C装置。___________

(5)测定Na2S2O3·5H2O的纯度:称取Wg产品,用适量蒸馏水溶解,滴加少量淀粉溶液,用0.1000mol·L-1碘的标准溶液滴定,反应原理为2S2O32-+I2=S4O62-+2I-。
①判断反应达到滴定至终点的标志是:______________________________。
②滴定起始和终点的液面位置如图,则产品的纯度为(Na2S2O·5H2O的摩尔质量为Mg·mol-1)____________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:
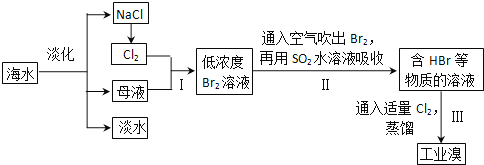
(1)除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序正确的是__________。
A、NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B、BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸
C、NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤后加盐酸
D、Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
(2)步骤I中已获得Br2,步骤II中又将Br2还原为Br一,其目的是富集。发生反应的化学方程式:______________________。
(3)某化学小组的同学为了了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,设计了如下实验装置:
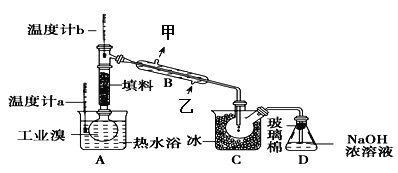
①图中仪器B的名称是______,冷却水的出口为_______(填“甲”或“乙”)。
②D装置的作用是________________。
(4)已知某溶液中Cl一、Br一、I一的物质的量之比为2:3:4,现欲使溶液中的Cl一、Br一、I一的物质的量之比变成4:3:2,那么要通入C12的物质的量是原溶液中I一的物质的量的____________(填选项)。
A、1/2 B、1/3 C、1/4 D、1/6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【题目】一定温度下,反应N2(g)+3H2(g)![]() 2NH3(g)达到化学平衡状态的标志是
2NH3(g)达到化学平衡状态的标志是
A. c(N2):c(H2):c(NH3)=1:3:2
B. N2、H2和NH3的物质的量分数不再改变
C. N2与H2的物质的量之和是NH3的物质的量的2倍
D. 单位时间里每增加lmolN2,同时增加3molH2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com