
25℃时,几种弱酸的电离常数如下:
| 弱酸的化学式 | CH3COOH | HCN | H2S |
| 电离常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=1.3×10-7 K2=7.1×10-15 |
25℃时,下列说法正确的是( )
A.等物质的量浓度的各溶液pH关系为:pH(CH3COONa)> pH(Na2S) > pH(NaCN)
B.a mol/LHCN溶液与b mol/LNaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定大于b
C.NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)
D.某浓度的NaCN溶液的pH=d,则其中由水电离出的c(OH-)=10-dmol/L
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
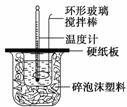 某实验小组设计用50 mL 1.0 mol/L盐酸跟50 mL 1.1 mol/L 氢氧化钠溶液在如图装置中进行中和反应。在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过。通过测定反应过程中所放出的热量可计算中和热。试回答下列问题:
某实验小组设计用50 mL 1.0 mol/L盐酸跟50 mL 1.1 mol/L 氢氧化钠溶液在如图装置中进行中和反应。在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过。通过测定反应过程中所放出的热量可计算中和热。试回答下列问题:
(1)本实验中用稍过量的NaOH的原因教材中说是为保证盐酸完全被中和。试问:盐酸在反应中若因为有放热现象,而造成少量盐酸在反应中挥发,则测得的中和热____________(填“偏大”、“偏小”或“不变”)。
(2)在中和热测定实验中存在用水洗涤温度计上的盐酸的步骤,若无此操作步骤,则测得的中和热会____________(填“偏大”、“偏小”或“不变”)。
(3)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会____________(填“偏大”、“偏小”或“不变”),其原因是_______________________________________________。
(4)该实验小组做了三次实验,每次取溶液各50 mL,并记录下原始数据(见下表)。
| 实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差(t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
已知盐酸、NaOH溶液密度近似为1.00g/cm3,中和后混合液的比热容c=4.18×10-3kJ/(g·℃),则该反应的中和热为ΔH=______ __。根据计算结果,写出该中和反应的热化学方程式_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下述三个实验均能发生化学反应,下列判断正确的是:
①将铁钉放入硫酸铜溶液中 ②向硫酸亚铁溶液中滴入几滴双氧水 ③将铜丝放入氯化铁溶液中
A.实验①中铁钉做氧化剂 B.实验②中Fe2+具有还原性
C.实验③中发生的是置换反应 D.上述实验证明氧化性Fe3+>Fe2+>Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学用语表述正确的是
A.羟甲基(-CH2OH)和甲氧基(CH3O-)电子数不相等
B.S2-的结构示意图:
C.质子数为53,中子数为78的碘原子:
D.苯甲醛: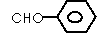
查看答案和解析>>
科目:高中化学 来源: 题型:
通过NOx传感器可监测NOx的含量,其工作原理示意图如下:

下列说法正确的是 ( )
A.NiO 电极是该电池的正极
B.Pt电极附近的pH 增大
C.NiO 电极的电极反应式:NO—2e—+O2—=NO2
D.固体电解质中O2-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
草酸(H2C2O4)是一种重要的有机化工原料。为探究草酸的制取和草酸的性质,进行如下实验。
实验Ⅰ:实验室用硝酸氧化淀粉水解液法制备草酸,装置如下图所示
①一定量的淀粉水解液加入三颈烧瓶中

②控制反应温度55-60℃,边搅拌边缓慢滴加一定量的混合酸(65%的HNO3与98%的H2SO4的质量比2︰1.25)
③反应3小时,冷却,抽滤后再重结晶得到草酸晶体
硝酸氧化淀粉水解液的反应为:
C6H12O6+12HNO3 3H2C2O4+9NO2↑+3NO↑+9H2O
3H2C2O4+9NO2↑+3NO↑+9H2O
(1)上图实验装置中仪器乙的名称为:________________________。
装置B的作用是 。
(2)检验淀粉是否水解完全的方法:______________________________________________。[
实验Ⅱ:探究草酸与酸性高锰酸钾的反应
(3)向草酸溶液中逐滴加入硫酸酸化的高锰酸钾溶液时,可观察到溶液由紫红色变为近乎无色,写出上述反应的离子方程式:____________________________________________________。
(4)学习小组的同学发现,当向草酸溶液中逐滴加入硫酸酸化的高锰酸钾溶液时,溶液褪色总是先慢后快。为探究其原因,同学们做了如下对比实验;

由此你认为溶液褪色总是先慢后快的原因是_________________________________________。
(5)草酸亚铁在工业中有重要作用,草酸可以制备草酸亚铁,步骤如下:
称取FeSO4·7H2O 固体于小烧杯中,加入水和少量稀H2SO4溶液酸化,加热溶解。向此溶液中加入一定量的H2C2O4溶液,将混合溶液加热至沸,不断搅拌,以免暴沸,待有黄色沉淀析出并沉淀后,静置。倾出上清液,再加入少量水,并加热,过滤,充分洗涤沉淀,过滤,用丙酮洗涤固体两次并晾干。
①生成的草酸亚铁需充分洗涤沉淀,检验是否洗涤完全的方法是 。
②用丙酮洗涤固体两次的目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
不能用于判断金属失电子能力强弱的是
A.同主族金属元素原子半径大小
B.1 mol金属单质在反应中失去电子的多少
C.水溶液中金属间发生的置换反应
D.金属元素最高价氧化物对应水化物的碱性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学用语表达正确的是

A.Cl-的结构示意图:
|
|
 H H
H H

 C. CH4Si的结构式: C—Si
C. CH4Si的结构式: C—Si
H H
D. 质量数为137的钡原子: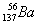
查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列化学反应的离子方程式是( )
A.金属铝溶于盐酸中:Al+2H+=Al3++H2↑
B.碳酸镁溶于硝酸中:2H++CO32-=CO2↑+H2O
C.在澄清石灰水中通入过量的CO2:Ca2++2OH-+CO2=CaCO3↓+H2O
D.硫酸氢钠溶液中加入碳酸氢钠溶液:H++HCO3-=CO2↑+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com