
【题目】已知常温时HClO的Ka=3.0×10-8,HF的Kb=3.5×10-4。现将pH和体积都相同的次氯酸和氢氟酸溶液分別加蒸馏水稀释,pH随溶液体积的变化如图所示,下列叙述正确的是( )

A. 曲线Ⅰ为次氯酸稀释时pH变化曲线
B. 取a点的两种酸溶液,中和相同体积、相同浓度的NaOH溶液,消耗氢氟酸的体积较小
C. b点溶液中水的电离程度比c点溶液中水的电离程度小
D. 从b点到d点,溶液中![]() 保持不变(HR代表HClO或HF)
保持不变(HR代表HClO或HF)
【答案】D
【解析】pH相同的弱酸溶液加水稀释,其pH应该都会升高,其中酸性越强,其pH的变化应该越明显(或者说曲线的斜率应该越大),因为Kb>Ka,所以HF的酸性更强,所以曲线Ⅰ为氢氟酸稀释时pH变化曲线,选项A错误。中和相同体积、相同浓度的NaOH溶液,消耗的次氯酸和氢氟酸的物质的量一定相等,a点两者的pH相同,因为HF酸性更强,所以HF的溶度较小,达到相同的物质的量需要较大的体积,所以消耗的氢氟酸的体积较大,选项B错误。c点比b点的pH更小,说明c点酸电离出来的氢离子浓度更大,所以对于水的电离的抑制应该更强,水的电离程度应该是c点更小,选项C错误。![]() 可以认为是R-的水解平衡常数,该数值应该只与温度有关,所以选项D正确。
可以认为是R-的水解平衡常数,该数值应该只与温度有关,所以选项D正确。


科目:高中化学 来源: 题型:
【题目】取7.90g KMnO4,加热分解后剩余固体7.42g。该剩余固体与足量的浓盐酸在加热条件下充分反应,生成单质气体A,产物中锰元素只以Mn2+存在。下列说法中错误的是( )
A.反应过程中生成氧气的物质的量是0.015mol
B.气体A是氯气,它的物质的量是0.095mol
C.KMnO4的分解率是60%
D.整个反应过程中转移了0.19mole-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)检验溶液中Fe3+存在的常用试剂是___,证明Fe3+存在的现象是____,配制含Fe2+的溶液时,常常向溶液中加入少量___,使被氧气氧化形成的Fe3+还原为Fe2+。
(2)写出FeCl3溶液与金属铜发生反应的化学方程式:___。
(3)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得FeCl3溶液,准备采用下列步骤:
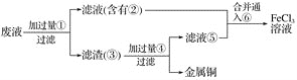
A.请写出上述实验中加入或生成的有关物质的化学式。
①___,②___,③___,④____,⑤____,⑥_____。
B.请写出相关反应的化学方程式。_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法,正确的是( )
A.由甲烷在纯氧中完全燃烧只生成CO2和H2O说明甲烷不含氧元素
B.![]() 最多有16个原子共平面
最多有16个原子共平面
C.油脂在人体内水解为氨基酸和甘油等小分子才能被吸收
D.甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在相同温度和压强下,对反应X(g)+Y(g)![]() Z(g)+W(g)进行四组实验,实验起始时放入容器内各组分的物质的量见表:
Z(g)+W(g)进行四组实验,实验起始时放入容器内各组分的物质的量见表:
实验 | X | Y | Z | W |
① | amol | amol | 0mol | 0mol |
② | 3amol | amol | 0mol | 0mol |
③ | 0mol | 0mol | amol | amol |
④ | 2amol | 0mol | amol | amol |
上述四种情况达到平衡后,n(Z)的大小顺序是( )
A. ②=④>①=③B. ②>④>①>③
C. ④>②>①=③D. ④>③>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
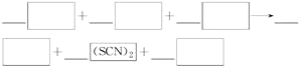
【题目】已知硫氰(SCN)2为拟卤素,其分子及阴离子的性质与卤素性质相似。完成下列填空:将硫氰化钾溶液与氯化铁溶液混合,溶液变为红色。
(1)写出该反应的化学方程式:________________________________。
(2)将生成的红色溶液分为三等份,进行如下实验(第三份是对照):
①第一份中滴加碘化钾溶液至过量,再加入四氯化碳,充分振荡,最终水层接近无色,四氯化碳层呈__________色,写出该过程的离子方程式:________________________。向该溶液中滴加少量溴水,水溶液又变为红色,则氧化性Br2________(填“大于”“小于”或“无法确定”) (SCN)2。
②第二份中加入少量酸性高锰酸钾溶液,血红色褪去。完成并配平该反应的离子方程式_________________。若含________mol高锰酸钾的溶液完全反应,转移电子2 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(H2C2O4,二元弱酸)与草酸盐在实验和工业生产中都起着重要的作用,常温下,H2C2O4:Ka1=5.4×10-2,Ka2=5.4×10-5。H2CO3:K1=4×10-7K2=6×10-11。
(1)NaHCO3溶液显____性。
(2)常温下,0.1mol·L-1的Na2C2O4溶液pH=a,0.1 mol·L-1的Na2CO3溶液pH=b,则a___b(填“>”“<”或“=”)。
(3)常温下,pH=3的H2C2O4溶液的物质的量浓度为c1,水电离出的c(H+)为c3;pH=4的H2C2O4溶液的物质的量浓度为c2,水电离出的c(H+)为c4。则c1_____10c2(填“>”“<”或“=”,下同);c3___10c4。
(4)常温下,用0.1000mol·L-1NaOH溶液滴定20.00mL某未知浓度的H2C2O4溶液,滴定曲线如图,c点所示溶液中:2c(C2O42-)+2c(HC2O4-)+2c(H2C2O4)=c(Na+)
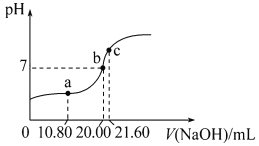
①该草酸溶液的物质的量浓度为_________(结果保留三位小数)。
②a点所示溶液中各离子的浓度由大到小的顺序为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以二甲醚(CH3OCH3)酸性燃料电池为电源,电解饱和食盐水制备氯气和烧碱,设计装置如图所示。已知:a电扱的反应式为O2+4H++4e-=2H2O,下列说法不正确的是( )
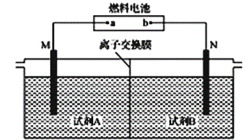
A.b电极的反应式为CH3OCH3+3H2O-12e-=2CO2↑+12H+
B.试剂A为饱和食盐水,试剂B为NaOH稀溶液
C.阴极生成1mol气体时,理论上导线中流过2mole-
D.阳极生成1mol气体时,有1mol离子通过离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化尿素[CO(NH2)2·H2O2]是一种无毒、无味的白色结晶粉末,具有尿素和过氧化氢双重性质,是一种新型的氧化剂和消毒剂,广泛应用于漂白、纺织、医药、农业、养殖业等领域。其合成如图:
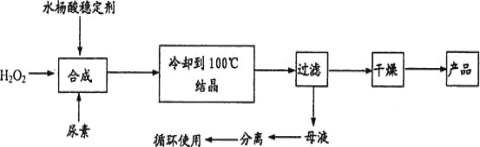
试回答下列问题:
(1)实际生产中需控制n(H2O2):n(CO(NH2)2)]=1.2:1,其主要原因是____。
(2)从母液中分离出H2O2和尿素,采用的操作是____。
a.盐析、过滤 b.分液、过滤 c.减压蒸馏、结晶 d.常压蒸馏、萃取
(3)为测定产品中活性氧的含量(活性氧16%,相当于H2O2 34%),称取干燥样品12.000g,溶解,在250mL容量瓶中定容。准确量取25.00mL于锥形瓶中,加入1mL 6mol/L的硫酸,然后用0.2000 mol/LKMnO4标准溶液滴定,三次滴定平均消耗KMnO4溶液20.00mL(KMnO4溶液与尿素不反应)。
①滴定终点的现象是:滴入最后一滴KMnO4溶液后____。
②容量瓶在使用前必须进行的操作是____。
③完成并配平方程式:__MnO4-+___H2O2+___H+=___Mn2++____H2O+____,__
④若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的活性氧含量___(选填:“偏高”、“偏低”或“不变”)。
⑤根据滴定结果,确定产品中活性氧的质量分数__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com