
【题目】取7.90g KMnO4,加热分解后剩余固体7.42g。该剩余固体与足量的浓盐酸在加热条件下充分反应,生成单质气体A,产物中锰元素只以Mn2+存在。下列说法中错误的是( )
A.反应过程中生成氧气的物质的量是0.015mol
B.气体A是氯气,它的物质的量是0.095mol
C.KMnO4的分解率是60%
D.整个反应过程中转移了0.19mole-
【答案】D
【解析】
根据2KMnO4![]() K2MnO4+MnO2+O2↑,n(O2)=
K2MnO4+MnO2+O2↑,n(O2)=![]() =0.015mol,则分解的高锰酸钾n(KMnO4)= 2n(O2)=0.03mol; 7.90g KMnO4物质的量为
=0.015mol,则分解的高锰酸钾n(KMnO4)= 2n(O2)=0.03mol; 7.90g KMnO4物质的量为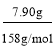 =0.05mol,若7.90g KMnO4不分解完全与浓盐酸完全反应,由方程式:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O分析知转移的电子为0.05mol×5=0. 25mol,分解高锰酸钾放出O2而转移的电子:0.015mol×4=0.06mol,因此实际生成单质气体Cl2转移的电子为0.25mol—0.06mol=0.19mol,生成的Cl2的n(Cl2)=
=0.05mol,若7.90g KMnO4不分解完全与浓盐酸完全反应,由方程式:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O分析知转移的电子为0.05mol×5=0. 25mol,分解高锰酸钾放出O2而转移的电子:0.015mol×4=0.06mol,因此实际生成单质气体Cl2转移的电子为0.25mol—0.06mol=0.19mol,生成的Cl2的n(Cl2)= ![]() =0.095mol。
=0.095mol。
A.根据2KMnO4![]() K2MnO4+MnO2+O2↑,n(O2)=
K2MnO4+MnO2+O2↑,n(O2)=![]() =0.015mol,A项正确;
=0.015mol,A项正确;
B.若7.90g KMnO4与浓盐酸完全反应,由方程式:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O分析知n(e—)=0.05mol×5=0. 25mol,分解高锰酸钾放出O2而转移的电子为0.015mol×4=0.06mol,因此生成单质气体Cl2转移的电子为0.25mol—0.06mol=0.19mol,生成的Cl2的n(Cl2)= ![]() =0.095mol,B项正确;
=0.095mol,B项正确;
C.n(KMnO4)=2n(O2)=0.03mol,则KMnO4的分解率: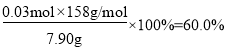 , C项正确;
, C项正确;
D.由B选项计算结果知整个过程转移电子n(e—)=0.05mol×5=0.25mol,生成单质气体Cl2转移的电子为0.25mol—0.06mol=0.19mol,D项错误;
答案选D。


 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的化工原料又是一种可再生能源,具有开发和应用的广阔前景。
(1)在一容积为2 L的密闭容器内,充入0.2 mol CO与0.4 mol H2发生反应,CO(g)+2H2(g)![]() CH3OH(g),CO的平衡转化率与温度,压强的关系如图所示。
CH3OH(g),CO的平衡转化率与温度,压强的关系如图所示。
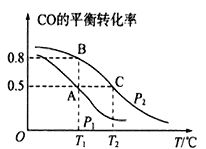
①A、B两点对应的压强大小关系是PA _______PB(填“>、<、=”)。
②在压强为P2时B、C两点的正反应速率大小关系是______________
③下列叙述能说明上述反应已达到化学平衡状态的是__________
A.H2的消耗速率是CH3OH生成速率的2倍 B.CH3OH的体积分数不再改变
C.混合气体的密度不再改变 D.CO和CH3OH的物质的量之比保持不变
(2)在压强为P1、温度为T1 ℃时,H2的平衡转化率为__________(计算出结果),再加入1.0 mol CO后重新到达平衡,则CO的转化率___________(填“增大”、“不变”或“减小”)。
(3) 在压强为P1、温度为T1 ℃时,1L的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下,CO:0.05 mol、H2:0.1mol、CH3OH:0.05mol。此时v(正)________v(逆)(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,已知醋酸的电离常数为1.75×10-5,向20mL0.01mol·L-1CH3COOH溶液中逐滴加入0.01mol·L-1的NaOH溶液,溶液中水电离的c(H+)随加入NaOH溶液的体积变化如图所示,下列说法正确的是(已知![]() =4.2)
=4.2)
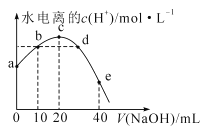
A.b、d两点溶液的pH相同
B.b点溶液中离子浓度大小顺序是:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.e点所示溶液中,c(Na+)=2[c(CH3COO-)+c(CH3COOH)]=0.005mol/L
D.a点坐标为(0,2.4×10-11)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在25℃,101kPa下,lg C8H18(辛烷)(相对分子质量:114)燃烧生成二氧化碳和液态水时放出48.40kJ热量。表示上述反应的热化学方程式正确的是( )
A. C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(g);△H=-48.40kJ·mol-1
B. C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1);△H=-5518kJ·mol-1
C. C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1);△H=+5518kJ·mol-1
D. C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1);△H=-48.40kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.22.4L氢气中含有的氢分子数目为NA
B.标准状况下,4.48L水中含有的水分子数目为0.2NA
C.常温常压下,14g氮气含有的氮原子数目为NA
D.0.2mol·L-1CaCl2溶液中含有的氯离子数目为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)若电解饱和食盐水时消耗117gNaCl,则理论上最多可得到___L(标准状况)氯气。
(2)为测定K2SO4溶液的浓度,取25.00mL待测液,向其中加入过量BaCl2溶液,充分反应后过滤并干燥,得到白色沉淀的质量是1.165g。该K2SO4溶液的物质的量浓度是多少?___(写出具体的计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某密闭容器中充入NO2,发生反应2NO2(g)![]() N2O4(g)。其它条件相同时,不同温度下平衡体系中各物质的物质的量分数如下表:(已知:N2O4为无色气体)
N2O4(g)。其它条件相同时,不同温度下平衡体系中各物质的物质的量分数如下表:(已知:N2O4为无色气体)
t/℃ | 27 | 35 | 49 | 70 |
NO2% | 20 | 25 | 40 | 66 |
N2O4% | 80 | 75 | 60 | 34 |
下列说法不正确的是( )
A.27℃,该平衡体系中的NO2转化率为![]()
B.平衡时,NO2的消耗速率为N2O4消耗速率的2 倍
C.室温时,将盛有NO2的密闭玻璃球放入冰水中其颜色会变浅
D.其他条件不变,增大NO2起始量,平衡正移,该反应的化学平衡常数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室用金属铜和稀硝酸制取NO的离子方程式为__。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。
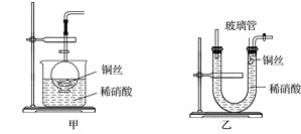
①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是__(填字母)。
A.铁 B.铝 C.铂 D.玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是__(填化学方程式)。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。
①长玻璃管的作用是__。
②让反应停止的操作方法及原因是__。
(4)以下收集NO气体的装置,合理的是__(填字母)。
A. B.
B.![]() C.
C. D.
D.![]() E.
E.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温时HClO的Ka=3.0×10-8,HF的Kb=3.5×10-4。现将pH和体积都相同的次氯酸和氢氟酸溶液分別加蒸馏水稀释,pH随溶液体积的变化如图所示,下列叙述正确的是( )

A. 曲线Ⅰ为次氯酸稀释时pH变化曲线
B. 取a点的两种酸溶液,中和相同体积、相同浓度的NaOH溶液,消耗氢氟酸的体积较小
C. b点溶液中水的电离程度比c点溶液中水的电离程度小
D. 从b点到d点,溶液中![]() 保持不变(HR代表HClO或HF)
保持不变(HR代表HClO或HF)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com