
����Ŀ���ظ������׳ƺ췯��(Na2Cr2O7��2H2O)������Ҫ�Ļ�����Ʒ��ǿ����������ҵ�Ʊ��췯�Ƶ��������£�
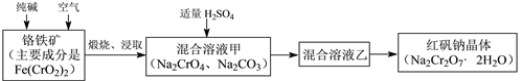
��1����Ԫ�������ڱ��е�λ��___________���Ƶ�ԭ�ӽṹʾ��ͼ_____________��
��2����ѧ�Ͽɽ�ijЩ��д�����������ʽ����Na2SiO3��д��Na2O��SiO2����Fe(CrO2)2��д��__________��
��3�����ո�����ʱ����ʯ�����ܵ�Fe(CrO2)2���ɿ�����ˮ��Na2CrO4����Ӧ��ѧ����ʽ���£�4Fe(CrO2)2+ 8Na2CO3+7O2 = 2Fe2O3+8Na2CrO4+8CO2 ��Ϊ�˼ӿ�÷�Ӧ�ķ�Ӧ���ʣ��ɲ�ȡ�Ĵ�ʩ��________________����дһ�ּ��ɣ�
��4����֪CrO42���ڲ�ͬ��������Һ���в�ͬ�ķ�Ӧ���磺2CrO42��+2H+= Cr2O72��+H2O��3CrO42��+4H+= Cr3O102��+2H2O
���������Һ���м����������������ԭ����__________________________________��
�ڻ����Һ�������ʵĻ�ѧʽ��______________________________________________��
��5����ƽ������Һ��ԭ���з��������ӷ�Ӧ��________________��
Cr2O72��+S2��+H2O��Cr(OH)3+S2O32��+OH��
���𰸡� �������ڵ�VIII�� 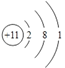 FeO��Cr2O3 �����ʯ�������¶� �������ܳ���Na2CO3������������������Na2Cr3O10�ȸ����� Na2Cr2O7��Na2SO4 4 6 19 8 3 14
FeO��Cr2O3 �����ʯ�������¶� �������ܳ���Na2CO3������������������Na2Cr3O10�ȸ����� Na2Cr2O7��Na2SO4 4 6 19 8 3 14
����������������봿�ͨ��������գ�����ȡ��õ�Na2CrO4��Na2CO3�������������ᣬ�õ������Һ�Һ���Na2Cr2O7��Na2SO4��Ȼ��ᾧ�ɵõ�Na2Cr2O7���壬��
��1����Ԫ�ص�ԭ��������26�������ڱ��е�λ���ǵ������ڵ�VIII�壬�Ƶ�ԭ�ӽṹʾ��ͼΪ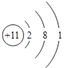 ����2��Fe(CrO2)2����Ԫ�ػ��ϼ���+2�ۣ�������ΪFeO����Ԫ�ػ��ϼ�+3�ۣ�������ΪCr2O3������Fe(CrO2)2д����������ʽΪFeO��Cr2O3����3������Ӧ��Ӵ�������Լӿ췴Ӧ���ʣ������¶ȿ��Դ��ӿ췴Ӧ���ʣ�����Ϊ�˼ӿ�÷�Ӧ�ķ�Ӧ���ʣ��ɲ�ȡ�Ĵ�ʩ�Ƿ����ʯ�������¶ȣ���4���������������Գ���̼���ƣ������ᷢ����Ӧ3CrO42��+4H+=Cr3O102��+2H2O��������Na2Cr3O10�ȸ�������Ա������������������ڷ����˷�Ӧ2CrO42��+2H+= Cr2O72��+H2O��������Na2Cr2O7��Na2SO4�������������ʵĻ�ѧʽΪNa2Cr2O7��Na2SO4����5��CrO42����Cr3+��1mol CrO42����õ������ʵ���Ϊ1mol��2����6-3��=6mol��S2-��S2O32����2molS2-ʧȥ�������ʵ���Ϊ2mol��[2-��-2��]=8mol�����ݵ���ת���غ㣬��С������Ϊ24�����Է��������ӷ�ӦΪ4Cr2O72��+6S2��+19H2O��8Cr(OH)3��+3S2O32��+14OH����
����2��Fe(CrO2)2����Ԫ�ػ��ϼ���+2�ۣ�������ΪFeO����Ԫ�ػ��ϼ�+3�ۣ�������ΪCr2O3������Fe(CrO2)2д����������ʽΪFeO��Cr2O3����3������Ӧ��Ӵ�������Լӿ췴Ӧ���ʣ������¶ȿ��Դ��ӿ췴Ӧ���ʣ�����Ϊ�˼ӿ�÷�Ӧ�ķ�Ӧ���ʣ��ɲ�ȡ�Ĵ�ʩ�Ƿ����ʯ�������¶ȣ���4���������������Գ���̼���ƣ������ᷢ����Ӧ3CrO42��+4H+=Cr3O102��+2H2O��������Na2Cr3O10�ȸ�������Ա������������������ڷ����˷�Ӧ2CrO42��+2H+= Cr2O72��+H2O��������Na2Cr2O7��Na2SO4�������������ʵĻ�ѧʽΪNa2Cr2O7��Na2SO4����5��CrO42����Cr3+��1mol CrO42����õ������ʵ���Ϊ1mol��2����6-3��=6mol��S2-��S2O32����2molS2-ʧȥ�������ʵ���Ϊ2mol��[2-��-2��]=8mol�����ݵ���ת���غ㣬��С������Ϊ24�����Է��������ӷ�ӦΪ4Cr2O72��+6S2��+19H2O��8Cr(OH)3��+3S2O32��+14OH����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڷ�Ӧ��2Na2O2 + 2H2O === 4NaOH + O2������˵������ȷ���� ( )
A. Na2O2����������H2O�ǻ�ԭ��
B. Na2O2���������������ǻ�ԭ��
C. �÷�Ӧ�е���ת�Ƶ���ĿΪ4e-
D. O2��������������ǻ�ԭ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ԭ���ڻ�ѧ��ҵ���й㷺Ӧ�á�
��1��������ͼװ�õ���Ʊ�NaOH�����缫�����Һ�ֱ�ΪNaOH��NaCl��Һ��
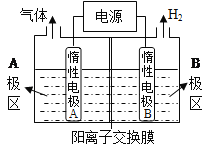
��B�������ҺΪ____________��Һ���ѧʽ����A��Ҫ���ӵ�Դ��_________(����������������)����
�������缫��ӦʽΪ__________________________________________����������Na+��____________�缫Ǩ�ƣ�����A������B������
�۵���ܷ�Ӧ�����ӷ���ʽ��________________________________________________��
��2��������ͼװ�ã�����ģ�����ĵ绯ѧ������
����XΪ̼�缫��Ϊ�������ĸ�ʴ������KӦ����________�������A������B������C����

����XΪп�缫������K����A�����õ绯ѧ��������Ϊ______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.2017��08��08��21ʱ19��46�����Ĵ������ݾ�կ���ط���7�����𡣵����Ϊ��ֹ�߲����У�ȫ�����������������˴�������������Ư���ȡ���ش�����������⣺
��1������������һЩƯ��������������Ч�ɷ֡�84����Һ����Ч�ɷ��Ǵ������ƣ���ȡ������Һ�Ļ�ѧ����ʽΪ_______��
��2����������(ClO2)��Ŀǰ�����Ϲ��ϵĵ��Ĵ���Ч�����Ĺ�����������������KClO3��Һ��һ����������SO2��Ӧ�Ƶá��÷�Ӧ�����ӷ���ʽΪ��_______��
��3��Ư����������(NaClO2)�ڳ��ºڰ����ɱ���һ�꣬��������ȶ��ɷֽ⣬��Ӧ�����ӷ���ʽΪ��HClO2��ClO2��+H++Cl-+H2O(δ��ƽ)��
��1 molHClO2�����ֽⷴӦʱ��ת�Ƶ��ӵ����ʵ�����_________mo1��
��.�弰�仯����㷺Ӧ�����л��ϳɡ���ѧ����������
��4����ˮ�����������Ԫ�صı仯���£�
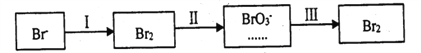
�ٹ���������ˮ�Լ��ԣ�����pH<3.5����ͨ������������ˮPH�����Cl2��������.��ƽ��ԭ��������ԭ����______________��
�ڹ����������ȿ�������ϳ�������Ũ̼������Һ���ա���ɲ���ƽ���з���ʽ��
_____Br2+_______Na2CO3 =______NaBrO3+_____CO2+____��
��5��NaBrO3��һ�ַ����Լ����������ữ��NaI��Һ����μ���NaBrO3��Һ��������2.6 mol NaBrO3ʱ����÷�Ӧ����Һ����͵�Ĵ�����ʽ�����ʵ����ֱ�Ϊ��
���� | I2 | Br2 | IO3- |
���ʵ���/mol | 0.5 | 1.3 |
��ԭ��Һ��NaI�����ʵ�����_______mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��X��Y��Z��W��Ԫ�����ڱ��е����λ������ͼ��ʾ������Wԭ�ӵ���������������������������������˵������ȷ������ ��

A. ԭ�Ӱ뾶��W>Z>Y>X
B. ����������Ӧˮ�����������X>W>Z
C. �����̬�⻯������ȶ��ԣ�Y>X>W>Z
D. Ԫ��X��Z��W������ϼ۷ֱ����������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����̼�������������ᷴӦ���ж�����̼����ų������������������̼���Ʒ�Ӧ��������̼�����ƺ��Ȼ��ƣ�������ų�������A��B��ƿ��ɫ��Һ������һƿ��ϡ���ᣬ��һƿ��̼������Һ��Ϊ�ⶨ��ƿ��Һ�ijɷּ����ʵ���Ũ�ȣ���������ʵ�飺 ��ȡ20mL A��Һ�������л�������B��Һ25mL�����ռ���112mL����״�������壮
��ȡ25mL B��Һ�������л�������A��Һ20mL�����ռ���56mL����״�������壮
��1��д���������������̼���Ʒ�Ӧ��������ų������ӷ���ʽ��
��2��Ϊʹ�����٢ڷ�Ӧ��ȫ��������������ϡ���ᡱ��̼������Һ����A��Һ�����ʵ���Ũ��ΪmolL��1 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�У�ˮ��Ϊ���������ǣ� ��
A. NaOH+HCl= NaCl+H2O B. CaO+H2O = Ca(OH)2
C. 2Na+2H2O= 2NaOH+H2�� D. Cl2+H2O = HCl + HClO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO2��Ϊ��Դ����������Ҫ���о����⣬��ҵ����CO2����ȼ�ϼ״��Ļ�ѧ����ʽ��CO2��g��+3H2��g�� ![]() CH3OH��g��+H2O��g�����ش��������⣺
CH3OH��g��+H2O��g�����ش��������⣺
��1����CO2�Ʊ��״������漰��Ӧ���£�
��Ӧ����CO2��g��+3H2��g��![]() CH3OH��g��+H2O��g����H1
CH3OH��g��+H2O��g����H1
��Ӧ����CO2��g��+H2��g��![]() CO��g��+H2O��g�� ��H2
CO��g��+H2O��g�� ��H2
��Ӧ����CO��g��+2H2��g��![]() CH3OH��g�� ��H3
CH3OH��g�� ��H3
��֪��Ӧ��Ӧ��Ӧ��Ļ�ѧƽ�ⳣ���ֱ�ΪK1��K2��K3����K1_______����K2��K3��ʾ��
��2��һ�������£���3L�����ܱ������г���һ������H2��CO2���о���Ӧ��CO2��g��+3H2��g��![]() CH3OH��g��+H2O��g�� ��H1��ʵ���÷�Ӧ���ڲ�ͬ��ʼͶ�����£���Ӧ��ϵ��CO2��ƽ��ת�������¶ȵĹ�ϵ��������ͼ��ʾ��
CH3OH��g��+H2O��g�� ��H1��ʵ���÷�Ӧ���ڲ�ͬ��ʼͶ�����£���Ӧ��ϵ��CO2��ƽ��ת�������¶ȵĹ�ϵ��������ͼ��ʾ��
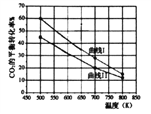
��H2��CO2����ʼ��Ͷ������A��B���ַ�ʽͶ�룺
A��n��H2��=3mol��n��CO2��=1.5mol��
B��n��H2��=3mol��n��CO2��=2mol
���ߢ����______������A������B����Ͷ�뷽ʽ��Ӧ����H1________0��������������������
�����¶�Ϊ500K�������£�����3molH2��1.5molCO2���÷�Ӧ5minʱ�ﵽƽ�⣬���¶��µ�ƽ�ⳣ��Ϊ_______��mol��L-1��-2
��500Kʱ�����ڴ������п�ʼ����0.3molH2��0.9molCO2��0.6molCH3OH��0.6molH2O����Ӧ��______������У�������Ӧ�������淴Ӧ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£���һ�������Ļ���������ܱ������з�����ӦaA(g) + bB(g) ![]() cC(g) + dD(g)���ﵽƽ��ʱ���B�����Ũ��Ϊ0.6mol/l�������½��ܱ��������ݻ�����һ�������´ﵽƽ��ʱ�����B�����Ũ��Ϊ 0.4mol/l��������������ȷ���ǣ� ��
cC(g) + dD(g)���ﵽƽ��ʱ���B�����Ũ��Ϊ0.6mol/l�������½��ܱ��������ݻ�����һ�������´ﵽƽ��ʱ�����B�����Ũ��Ϊ 0.4mol/l��������������ȷ���ǣ� ��
A. a+b��c+d
B. ƽ�������ƶ�
C. ���´�ƽ��ʱ��A����Ũ������
D. ���´�ƽ��ʱ��B�����������С
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com