
����Ŀ����.2017��08��08��21ʱ19��46�����Ĵ������ݾ�կ���ط���7�����𡣵����Ϊ��ֹ�߲����У�ȫ�����������������˴�������������Ư���ȡ���ش�����������⣺
��1������������һЩƯ��������������Ч�ɷ֡�84����Һ����Ч�ɷ��Ǵ������ƣ���ȡ������Һ�Ļ�ѧ����ʽΪ_______��
��2����������(ClO2)��Ŀǰ�����Ϲ��ϵĵ��Ĵ���Ч�����Ĺ�����������������KClO3��Һ��һ����������SO2��Ӧ�Ƶá��÷�Ӧ�����ӷ���ʽΪ��_______��
��3��Ư����������(NaClO2)�ڳ��ºڰ����ɱ���һ�꣬��������ȶ��ɷֽ⣬��Ӧ�����ӷ���ʽΪ��HClO2��ClO2��+H++Cl-+H2O(δ��ƽ)��
��1 molHClO2�����ֽⷴӦʱ��ת�Ƶ��ӵ����ʵ�����_________mo1��
��.�弰�仯����㷺Ӧ�����л��ϳɡ���ѧ����������
��4����ˮ�����������Ԫ�صı仯���£�
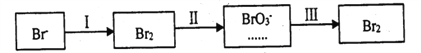
�ٹ���������ˮ�Լ��ԣ�����pH<3.5����ͨ������������ˮPH�����Cl2��������.��ƽ��ԭ��������ԭ����______________��
�ڹ����������ȿ�������ϳ�������Ũ̼������Һ���ա���ɲ���ƽ���з���ʽ��
_____Br2+_______Na2CO3 =______NaBrO3+_____CO2+____��
��5��NaBrO3��һ�ַ����Լ����������ữ��NaI��Һ����μ���NaBrO3��Һ��������2.6 mol NaBrO3ʱ����÷�Ӧ����Һ����͵�Ĵ�����ʽ�����ʵ����ֱ�Ϊ��
���� | I2 | Br2 | IO3- |
���ʵ���/mol | 0.5 | 1.3 |
��ԭ��Һ��NaI�����ʵ�����_______mol��
���𰸡� Cl2+2NaOH=NaCl+2NaClO+H2O 2ClO3-+SO2=2ClO2+SO42- 0.8 Cl2+H2O![]() H++Cl-+HClO������c(H+)��ƽ�������ƶ�������Cl2��ˮ�ķ�Ӧ 3 3 1 3 5NaBr 3
H++Cl-+HClO������c(H+)��ƽ�������ƶ�������Cl2��ˮ�ķ�Ӧ 3 3 1 3 5NaBr 3
����������1�����������ƺ�������Ӧ��ȡ����Һ����ѧ����ʽΪCl2+2NaOH=NaCl+2NaClO+H2O��
��2����KClO3��Һ��һ����������SO2��Ӧ�ƶ�������(ClO2)�����ӷ���ʽΪ2ClO3-+SO2=2ClO2+SO42-��
��3��������ȶ��ɷֽ⣬��Ӧ�����ӷ���ʽΪ��5HClO2=4ClO2��+H++Cl-+2H2O����Ӧ�е���ת�Ƶ���Ŀ��4e-�����Ե�1 molHClO2�����ֽⷴӦʱ��ת�Ƶ��ӵ����ʵ�����0.8mo1��
��. ��4���ٵ���ˮPH�����Cl2��������.��ƽ��ԭ��������ԭ����Cl2+H2O![]() H++Cl-+HClO������c(H+)��ƽ�������ƶ�������Cl2��ˮ�ķ�Ӧ��
H++Cl-+HClO������c(H+)��ƽ�������ƶ�������Cl2��ˮ�ķ�Ӧ��
�ڹ��̢����ȿ�������ϳ�������Ũ̼������Һ���գ���ѧ����ʽ��
3Br2+3Na2CO3 =NaBrO3+3CO2+5NaBr ��
��5��������֪��2.6 mol NaBrO3ǡ��ȫ��ת��Ϊ1.3mol Br2������+5�۽�Ϊ0������ת�Ƶ���13mol������0.5mol�⣬ת����1mol���ӣ�����NaIת��ΪIO3-��������ת����12mol��������Ļ��ϼ���-1���ߵ�+5�����Է������ֱ仯��n(NaI)= ![]() =2mol����ԭ��Һ��NaI�����ʵ�����0.5mol
=2mol����ԭ��Һ��NaI�����ʵ�����0.5mol![]() +2mol=3mol��
+2mol=3mol��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˼���ijFeCl2��Һ�Ƿ���ʣ�������Һ�м���(��)
A. Fe(SCN)3 B. ��Ƭ C. KSCN��Һ D. ʯ����Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ڳ��³�ѹ��ΪҺ����ǣ�������
A. ���� B. �Ҵ� C. ��ϩ D. ��Ȳ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)п��ϡ���ᷴӦ��______��Ӧ��������/���ȣ�
(2)���淴Ӧ����е�һ���̶�ʱ����Ӧ����������Ũ�Ȳ�����ʱ����ӳ��������ı䣬����Ӧ���ʺ��淴Ӧ����______������״̬��Ϊ________״̬��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯������������������������Ҫ����;����֪�����������£�����ˮ��Һ����Sn2+��Sn4+������Ҫ������ʽ��Sn2+�ױ���������ˮ�����ɼ�ʽ�Ȼ�����(Sn(OH)Cl)��SnCl4����ˮ�⡣�밴Ҫ��ش�����������⣺
��1����ԭ�ӵĺ˵����Ϊ50������ԭ�ӽṹʾ��ͼΪ________________��
��2�� SnCl2��ĩ���Ũ��������ܽ⣬����ƽ���ƶ�ԭ������ԭ��____________��
SnCl4����������ˮ����Ũ��״�������������Ļ�����䷴Ӧ�Ļ�ѧ����ʽΪ______________��
��3����������(SnSO4)��һ����Ҫ�������Σ��㷺Ӧ���ڶ�����ҵ��ij�о�С�����SnSO4�Ʊ�·�����£�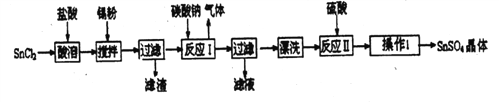
�ٲ�������___________��
�ڼ���Sn�۵�������������a.������ҺpH�� b.__________.
�۷�Ӧ���õ�������SnO���õ��ó��������ӷ�Ӧ����ʽ��______________��
��4�����ۿ���������������������С��ͨ�����з����ⶨ�������۵Ĵ��ȣ����ʲ����뷴Ӧ����
�ٽ�1.2g�������������У������ķ�ӦΪ��Sn+2HCl=SnCl2+H2�����ڼ��������FeCl3������0.1 mol/L��K2Cr2O7�ζ����ɵ�Fe2+ (��֪���Ի����£�Cr2O72-�ɱ���ԭΪCr3+)������ȥK2Cr2O7��Һ32mL������������������������_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾ����������ʯī������ʢ�б���NaCl��Һ��U���С����з�����ȷ���ǣ� ��

A. K1�պϣ������Ϸ����ķ�ӦΪ2H����2e����H2��
B. K1�պϣ�ʯī����Χ��ҺpH������
C. K2�պϣ��������ᱻ��ʴ��������������������������
D. K2�պϣ���·��ͨ��0.002NA������ʱ������������0.001mol����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ظ������׳ƺ췯��(Na2Cr2O7��2H2O)������Ҫ�Ļ�����Ʒ��ǿ����������ҵ�Ʊ��췯�Ƶ��������£�
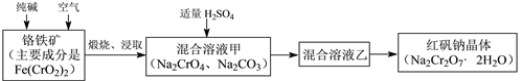
��1����Ԫ�������ڱ��е�λ��___________���Ƶ�ԭ�ӽṹʾ��ͼ_____________��
��2����ѧ�Ͽɽ�ijЩ��д�����������ʽ����Na2SiO3��д��Na2O��SiO2����Fe(CrO2)2��д��__________��
��3�����ո�����ʱ����ʯ�����ܵ�Fe(CrO2)2���ɿ�����ˮ��Na2CrO4����Ӧ��ѧ����ʽ���£�4Fe(CrO2)2+ 8Na2CO3+7O2 = 2Fe2O3+8Na2CrO4+8CO2 ��Ϊ�˼ӿ�÷�Ӧ�ķ�Ӧ���ʣ��ɲ�ȡ�Ĵ�ʩ��________________����дһ�ּ��ɣ�
��4����֪CrO42���ڲ�ͬ��������Һ���в�ͬ�ķ�Ӧ���磺2CrO42��+2H+= Cr2O72��+H2O��3CrO42��+4H+= Cr3O102��+2H2O
���������Һ���м����������������ԭ����__________________________________��
�ڻ����Һ�������ʵĻ�ѧʽ��______________________________________________��
��5����ƽ������Һ��ԭ���з��������ӷ�Ӧ��________________��
Cr2O72��+S2��+H2O��Cr(OH)3+S2O32��+OH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ�ˮ��Һ������ˮ��������Ե��ǣ� ��
A.NaCl
B.Na2CO3
C.NaHSO4
D.NH4Cl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У������ķ�������ͬ���ǣ� ��
A.10g H2��10g O2
B.5.6L N2��0.25mol CO2
C.0.5 NA��H2O��0.5mol I2
D.32g O2��32g O3
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com