
分析 (1)根据相对密度计算出有机物A的相对分子量,然后根据含有碳氢的质量分数确定其分子中C、H原子数,再根据总分子量确定含有氧原子数目即可;
(2)根据计算出的A的分子式确定其可能的结构简式.
解答 解:(1)A蒸气的密度是相同条件下H2密度的30倍,则A的相对分子量为:2×30=60,A分子中含碳40%,氢6.7%,则A分子中含有C、H原子数分别为:N(C)=$\frac{60×40%}{12}$2、N(H)=$\frac{60×6.7%}{1}$=4,则含有氧原子的数目为:N(O)=$\frac{60-12×2-1×4}{16}$=2,则A的分子式为:C2H4O2,
故答案为:C2H4O2;
(2)分子式为的有机物可能为乙酸,有可能为甲酸甲酯,所以可能的结构简式为:CH3COOH、HCOOCH3,
故答案为:CH3COOH、HCOOCH3.
点评 本题考查了有机物分子式、结构简式的确定,题目难度中等,注意掌握质量守恒定律在确定有机物分子式中的应用方法,明确同分异构体的书写原则.


科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将pH试纸放入溶液,观察其颜色变化,跟标准比色卡比较 | |
| B. | 用干燥洁净的玻璃棒蘸取溶液,滴在pH试纸上,跟标准比色卡比较 | |
| C. | 用蒸馏水湿润pH试纸,用玻璃棒蘸取溶液,滴在pH试纸上,跟标准比色卡比较 | |
| D. | 在试管内放入少量溶液煮沸,把pH试纸放在试管口上观察,跟标准比色卡比较 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2和SiO2 | B. | Na和I2 | C. | 蔗糖和干冰 | D. | 金刚石和石墨 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 常温下,浓度均为0.1mol•L-1的四种溶液:
常温下,浓度均为0.1mol•L-1的四种溶液:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
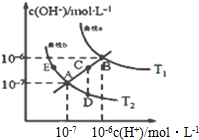 水的电离常数如图两条曲线所示,曲线中的点都符合c(H+)×c(OH-)=常数,下列说法错误的是( )
水的电离常数如图两条曲线所示,曲线中的点都符合c(H+)×c(OH-)=常数,下列说法错误的是( )| A. | 图中温度T1>T2 | |
| B. | 图中五点Kw间的关系:B>C>A=D=E | |
| C. | 曲线a、b可以表示纯水的电离情况 | |
| D. | 若处在B点时,将pH=2的硫酸溶液与pH=11的KOH溶液等体积混合后,溶液显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com