
����Ŀ�����õ�FeSO4��Һ��ƣ�һ����Ϊ��Fe2+��������Ե�ʡ��ش��������⣺
(1)���õ�FeSO4��Һ��Fe3+�ļ��飺����õ�FeSO4��Һ�м���KSCN������Ϊ��______________________________
(2)��ȥ����FeSO4��Һ��Fe3+������Һ�м����������ۣ����Թ۲쵽������Ϊ��______________________����Ӧ�����ӷ���ʽΪ��____________________________
(3)�������ϣ���Һ��Fe2+���������̷�Ϊ������������Fe2+ˮ��ΪFe(OH)2������ˮ����ﱻO2������д��Fe(OH)2�ڿ����б�����������Ϊ_________________________д����ѧ����ʽ������˫���ű�ע����ת�ƣ�________________________________
���𰸡���Һ�ɻ�ɫ���Ѫ��ɫ ��Һ�ɻ�ɫ���dz��ɫ 2Fe3+ +Fe=3Fe2+ ��ɫ��״���ɻ���ɫ������ɺ��ɫ���� 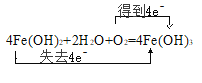
��������
��1��![]() ������Ϊ
������Ϊ![]() ��
��![]() ����KSCN��Һ��ʾѪ��ɫ��
����KSCN��Һ��ʾѪ��ɫ��
��2��![]() ���������ԣ�
���������ԣ�![]() ��
��
��3��![]() Ϊ��ɫ��״����������������Ϊ��ɫ��״���ɻ���ɫ������ɺ��ɫ������������ԭ��Ӧ���ɱ������ת�Ƶ������
Ϊ��ɫ��״����������������Ϊ��ɫ��״���ɻ���ɫ������ɺ��ɫ������������ԭ��Ӧ���ɱ������ת�Ƶ������
��1��![]() ��ҺΪ��ɫ��
��ҺΪ��ɫ��![]() ����KSCN��Һ��ʾѪ��ɫ������Һ�л�ɫ��ΪѪ��ɫ��
����KSCN��Һ��ʾѪ��ɫ������Һ�л�ɫ��ΪѪ��ɫ��
��2�������Ӿ��������ԣ������۷�Ӧ�����������������ӣ���Ӧ�����ӷ���ʽΪ��![]() ������Һ�ɻ�ɫ��Ϊdz��ɫ��
������Һ�ɻ�ɫ��Ϊdz��ɫ��
��3��![]() Ϊ��ɫ��״����������������Ϊ��ɫ��״���ɻ���ɫ������ɺ��ɫ��������Ӧ�ķ���ʽΪ��
Ϊ��ɫ��״����������������Ϊ��ɫ��״���ɻ���ɫ������ɺ��ɫ��������Ӧ�ķ���ʽΪ��![]() ����Ӧ����Ԫ����0�۽��͵�-2�ۣ�������������4�ۣ�ת���˵���4e-��˫���ű�ʾ����ת��Ϊ��
����Ӧ����Ԫ����0�۽��͵�-2�ۣ�������������4�ۣ�ת���˵���4e-��˫���ű�ʾ����ת��Ϊ�� ��
��


 ״Ԫ��ȫ��ͻ�Ƶ�����ϵ�д�
״Ԫ��ȫ��ͻ�Ƶ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������A�Ǻϳ���Ȼ�ĵ��壬����ʽΪC5H8��A��һϵ�з�Ӧ����(���ַ�Ӧ������ȥ)��

��֪��
�ش��������⣺
(1)A�Ľṹ��ʽΪ_____________����ѧ������________________________��
(2)B�ķ���ʽΪ__________________________��
(3)�ڷ�Ӧ�Ļ�ѧ����ʽΪ_____________________________________��
(4)�ٺ͢۵ķ�Ӧ���ͷֱ���___________��______________��
(5)CΪ�������������������Ǽ����ܵĻ�ѧ����ʽ��______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ���������ȷ���ǣ���
A.������ˮ��Al3++3H2O![]() Al(OH)3��+3H+
Al(OH)3��+3H+
B.�Ȼ������ˮ��NH4++H2O![]() NH3H2O+H+
NH3H2O+H+
C.��������Һ�У�H2SO3![]() 2H++SO32-
2H++SO32-
D.��С�մ���Һ�еμ��������ƣ�HCO3��+OH��=CO2��+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��X��Ϊ��ѧ���������ʣ�һ�����������ǵ�ת����ϵ���£�����������ȥ����
A![]() B
B![]() C
C
�Իش�
��1����XΪO2����A��������_____����ѡ���
a��Si b��NH3c��Mg d��S
��2����A��B��C��ˮ��Һ���Լ��ԣ���ɫ��Ӧ��Ϊ��ɫ��XΪCO2�������ӷ���ʽ����B��Һ�Լ��Ե�ԭ��__________���ٳ�C��һ����;__________��
��3����A��һ�ֻ���ɫ���嵥�ʣ�X��һ����ʹʪ��ĺ�ɫʯ����ֽ���������壬��Ӧ�������û���Ӧ��д����Ӧ���Ļ�ѧ����ʽ___________��C��ˮ��Һ�и�����Ũ���ɴ�С˳��Ϊ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����ャҺ��Al(OH)3��MnO2������Na2CrO4�����ǵ��������������ʹNa2CrO4������ȫ��ˮ������ij�о�С��������Ƶĵ�����װ�ã���ͼ2����ʹ��Һ����ɹ�������ͺ���Ԫ����Һ�����������á��ش��͢��е����⡣

��������ķ�������ã�����ͼ�еIJ��ַ�������ͷ�Ӧ����δ������
��1����Ӧ�������Լ�NaOH�ĵ���ʽΪ_________��B��C�ķ�Ӧ����Ϊ__________��C��Al���Ʊ�������Ϊ______________��
��2����С��̽����Ӧ�ڷ�����������D��Ũ�����ϣ������ȣ��ޱ仯��������Cl2���ɣ�����Ӧֹͣ������ʣ�࣬��ʱ�μ����ᣬ�ֲ���Cl2���ɴ��ж�Ӱ��÷�Ӧ��Ч���е������У�����ţ�___________��
a���¶� b��Cl-��Ũ�� c����Һ�����
��3��0.1 mol Cl2�뽹̿��TiO2��ȫ��Ӧ������һ�ֻ�ԭ�������һ����ˮ���TiO2��xH2O��Һ̬���������4.28 kJ���÷�Ӧ���Ȼ�ѧ����ʽΪ__________��
����Ԫ����Һ�ķ��������
��4���ö��Ե缫���ʱ��CrO42-�ܴӽ�Һ�з��������ԭ����__________�������Ԫ�ص�������_________�����������ɵ�����Ϊ___________��д��ѧʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ���漰�����ʾ�Ϊ��ѧ��ѧ�еij������ʣ�����C��D��EΪ���ʣ�EΪ���壬FΪ�д��ԵĻ��������֮��������¹�ϵ(��Ӧ�����ɵ�ˮ����Ҫ���������ȥ)��
��1��д���������ʵĻ�ѧʽ��B________��E________��
��2��ָ��MnO2����ط�Ӧ�е����ã���Ӧ������________������Ӧ������________����
��3������Ӧ�����ڼ��������½��У���A��________(�ѧʽ)������Ӧ�����ڳ��������½��У���A��________(�ѧʽ)�������������������µõ���������C���ʣ���Ӧ��ת�Ƶĵ�����֮��Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
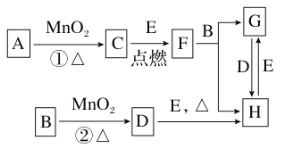
����Ŀ���Ҵ�����ȡ���ϡ��㾫��Ⱦ�ϡ�Ϳ�ϡ�ϴ�Ӽ��Ȳ�Ʒ��ԭ�ϡ�
���������գ�
��1��ʵ�������Ҵ���ȡ��ϩʱ��Ũ���������ԶԶ������Ϊ����������������ԭ����______��
��2����֤��ϩ�ӳɷ�Ӧ����ʱ�������ϩ�����еĸ������ʽ��д�������ѡ�õ��Լ���_____����д��ѧʽ������ȷ����ϩͨ����ˮ�з����˼ӳɷ�Ӧ����ʵ��______����ѡ���ţ�
a����ˮ��ɫ b������״��������
c����Ӧ��ˮ��Һ������ǿ d����Ӧ��ˮ��Һ�ӽ�����
��3��ʵ�������Ҵ��������Ʊ���������ʱ���ס�������װ����ͼ1������ѡ�á�����������װ�õ�˵����ȷ����______����ѡ���ţ�

a����װ������ת���ʸ� b����װ������ת���ʸ�
c����װ��������������ʩ d����װ��������������ʩ
��4������װ��ʵ��ʱ���ᴿ��������������������ͼ3�����������Լ�A�Ļ�ѧʽ��______���������������______��������һ�������ڷ���______����
��5����ͼ2�����Ҵ��Ʊ��������װ�ã�ʵ���������ּ��Ϸ�����
���ȼ��廯�����ټ��Ҵ�������1��1Ũ���
���ȼ��廯�����ټ�1��1Ũ�����������Ҵ���
�������ٺ͢�ʵ��ʱ�����ﶼ��������ɫ�������Թ��м���______������ɱ�Ϊ��ɫ���뷽������Ƚϣ������ڵ�����ȱ����______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1.0mol��L��1 NaOH��Һ�к�ijŨ��������Һʱ����pH������NaOH��Һ�������ϵ��ͼ��ʾ��ԭ������Һ�����ʵ���Ũ�Ⱥ���ȫ��Ӧ����Һ���������

A��1mol��L��1,60mL B��0.5mol��L��1,80mL
C��0.5mol��L��1,40mL D��1mol��L��1.80mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йذ��������в���ȷ����(����)
A. �������е�Ԫ�صĻ��ϼ�ֻ�����ߣ������л�ԭ��
B. ���Ĵ�������Ӧ�Ļ�ѧ����ʽ��4NH3��5O2![]() 4NO��6H2O
4NO��6H2O
C. ���Ĵ�������Ӧ���������������к���ɫ��������
D. ���Ĵ����������˹����Ĺ̶�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com