
【题目】Ⅰ、晶体硅(熔点1410℃)是良好的半导体材料,由粗硅制纯硅过程如下:
![]()
在上述由SiCl4制纯硅的反应中,测得每生成1.12 kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:_________。
Ⅱ、目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3.25 mol H2,在一定条件下发生反应,测定CO2、CH3OH(g)和H2O(g)的浓度随时间变化如下图所示:
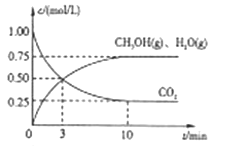
(1)从反应开始到平衡,氢气的平均反应速率υ(H2)=__________ 。
(2)该条件下CO2的转化率为_______。
Ⅲ、下图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题:

(1)M极的电极材料为 ___________________。
(2)加入乙醇的铂电极的电极反应式为___________。
(3)在此过程中乙池中某一电极析出金属银4.32g时,此时乙池溶液的体积为400mL,则乙池中溶液的pH为____________。
【答案】SiCl4(g) + 2H2(g)![]() Si(s) + 4HCl(g) ΔH= +0.025a kJ·mol-1 0.225 mol/(L·min) 75% 铁 C2H5OH-12e- + 16OH- = 2CO32-+ 11H2O 1
Si(s) + 4HCl(g) ΔH= +0.025a kJ·mol-1 0.225 mol/(L·min) 75% 铁 C2H5OH-12e- + 16OH- = 2CO32-+ 11H2O 1
【解析】
Ⅰ、1.12kg纯硅的物质的量为:![]() =40mol,生成40mol硅吸收akJ热量,则生成1mol硅吸收的热量为:
=40mol,生成40mol硅吸收akJ热量,则生成1mol硅吸收的热量为:![]() =0.025akJ,所以四氯化硅气体与氢气反应生成单质硅和氯化氢的热化学方程式为:2H2(g)+SiCl4(g)
=0.025akJ,所以四氯化硅气体与氢气反应生成单质硅和氯化氢的热化学方程式为:2H2(g)+SiCl4(g)![]() Si(s)+4HCl(g)△H=+0.025akJmol-1;
Si(s)+4HCl(g)△H=+0.025akJmol-1;
Ⅱ、(1)从反应开始到平衡,CO2的平均速率υ(CO2)=![]() =
=![]() =0.075mol/(Lmin),υ(H2)=3υ(CO2)=0.225mol/(Lmin);
=0.075mol/(Lmin),υ(H2)=3υ(CO2)=0.225mol/(Lmin);
(2)该条件下CO2的转化率为![]() ;
;
Ⅲ、碱性乙醇燃料电池为原电池,通入乙醇的电极是负极,通入氧气的电极是正极,乙池有外接电源,属于电解池,根据装置图,N是阳极,M是阴极,工作时M、N两个电极的质量都不减少,则M电极是铁,N电极是石墨,
(1)通过以上分析知,M是阴极,N极是阳极,工作时M、N两个电极的质量都不减少,故铁电极应为阴极;
(2)乙醇电极上乙醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为:C2H5OH-12e- + 16OH- = 2CO32-+ 11H2O;
(3)n(Ag)=![]() =0.04mol,根据Ag++e-=Ag可知转移电子为0.04mol,阳极电极反应为2H2O-4e-=O2↑+4H+,乙池中某一电极析出金属银4.32g时,同时产生氢离子的物质的量是0.04mol,则H+浓度是0.1mol/L,所以溶液的pH=1。
=0.04mol,根据Ag++e-=Ag可知转移电子为0.04mol,阳极电极反应为2H2O-4e-=O2↑+4H+,乙池中某一电极析出金属银4.32g时,同时产生氢离子的物质的量是0.04mol,则H+浓度是0.1mol/L,所以溶液的pH=1。


科目:高中化学 来源: 题型:
【题目】下列分子中,各分子的空间构型、中心原子的杂化方式以及孤电子对数均正确的是
选项 | 分子 | 空间构型 | 杂化方式 | 孤电子对数 |
A | NH3 | 平面三角形 | sp3杂化 | N含有一对孤电子对 |
B | CCl4 | 正四面体 | sp3杂化 | C不含有孤电子对 |
C | H2O | V形 | sp2杂化 | O含有两对孤电子对 |
D | CO32- | 三角锥形 | sp3杂化 | C含有一对孤电子对 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期表的说法正确的是
A. 元素周期表是按照元素相对原子质量大小排列而成的
B. 元素周期表有7个横行,也是7个周期;有18个纵行,即18个族
C. 凡是位于元素周期表中同一周期的元素,都是按从左到右的顺序原子最外层电子数由1递增到8
D. 凡是位于元素周期表中同一主族的元素,都是按从上到下的顺序电子层数逐渐增多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为对10 mL一定物质的量浓度的盐酸X用一定物质的量浓度的NaOH溶液Y滴定的图像,依据图像推出X和Y的物质的量浓度是下表内各组中的( )

A | B | C | D | |
X/(mol/L) | 0.12 | 0.04 | 0.03 | 0.09 |
Y/(mol/L) | 0.04 | 0.12 | 0.09 | 0.03 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机锌试剂(R—ZnBr)与酰氯(![]() )偶联可用于制备药物Ⅱ:
)偶联可用于制备药物Ⅱ:

(1)化合物Ⅰ的分子式为_____________。
(2)关于化合物Ⅱ,下列说法正确的有______(双选)。
A.可以发生水解反应 |
B.可与新制的Cu(OH)2共热生成红色沉淀 |
C.可与FeCl3溶液反应显紫色 |
D.可与热的浓硝酸和浓硫酸混合液反应 |
(3)化合物Ⅲ含有3个碳原子,且可发生加聚反应,按照途径1合成线路的表示方式,完成途经2中由Ⅲ到Ⅴ的合成路线:_____________(标明反应试剂,忽略反应条件)。
(4)化合物Ⅴ的核磁共振氢谱中峰的组数为_____________,以H替代化合物Ⅵ中的ZnBr,所得化合物的羧酸类同分异构体共有_____________种(不考虑手性异构)。
(5)化合物Ⅵ和Ⅶ反应可直接得到Ⅱ,则化合物Ⅶ的结构简式为:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CPAE是蜂胶的主要活性成分,也可由咖啡酸合成

下列说法不正确的是
A.咖啡酸分子中所有原子可能处在同一个平面上
B.可用金属Na检测上述反应是否残留苯乙醇
C.1 mol 苯乙醇在O2中完全燃烧,需消耗10 mol O2
D.1 mol CPAE与足量的NaOH溶液反应,最多消耗3 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构式为 ,它在一定条件下能发生的反应有( )
,它在一定条件下能发生的反应有( )
①加成 ②水解 ③酯化 ④氧化 ⑤中和 ⑥消去
A. ②③④ B. ①③⑤⑥ C. ①③④⑤ D. ②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A( C11H8O4 )是一种酯类物质,在NaOH溶液中加热反应后再酸化可得到化合物B和C。回答下列问题:
(1) B的分子式为C2H4O2,分子中只有一个官能团,且与NaHCO3溶液反应有气体产生。则B的结构简式是_______,写出B与NaHCO3溶液反应的化学方程式:______________。
写出两种能发生银镜反应的B的同分异构体的结构简式______________、__________________ 。
(2) C是芳香化合物(含有苯环的有机物),相对分子质量为180,其碳的质量分数为60.0%,氢的质量分数为4.4%,其余为氧,则C的分子式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应m A(g)+n B(g) ![]() p C(g) △H,在密闭容器中进行,下图表示在不同反应时间t 时温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线。由曲线分析,下列判断正确的是
p C(g) △H,在密闭容器中进行,下图表示在不同反应时间t 时温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线。由曲线分析,下列判断正确的是

A. T1<T2,P1>P2,m+n>p,△H<0
B. T1>T2,P1<P2,m+n>p,△H>0
C. T1<T2,P1>P2,m+n<p,△H<0
D. T1>T2,P1<P2,m+n<p,△H>0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com