
����Ŀ��������A( C11H8O4 )��һ���������ʣ���NaOH��Һ�м��ȷ�Ӧ�����ữ�ɵõ�������B��C���ش��������⣺
(1) B�ķ���ʽΪC2H4O2��������ֻ��һ�������ţ�����NaHCO3��Һ��Ӧ�������������B�Ľṹ��ʽ��_______��д��B��NaHCO3��Һ��Ӧ�Ļ�ѧ����ʽ��______________��
д�������ܷ���������Ӧ��B��ͬ���칹��Ľṹ��ʽ______________��__________________ ��
(2) C�Ƿ��㻯����(���б������л���)����Է�������Ϊ180����̼����������Ϊ60.0%�������������Ϊ4.4%������Ϊ������C�ķ���ʽ��____________��
���𰸡�CH3COOH CH3COOH + NaHCO3�� CH3COONa+ H2O + CO2�� HCOOCH3 CH2OHCHO C9H8O4
��������
�����⣺������A��C11H8O4��������������Һ�м��ȷ�Ӧ�����ữ�ɵõ�������B��C��˵��A�к���������
��1��B�ķ���ʽΪC2H4O2��������ֻ��һ�������ţ�������̼�����Ʒ�Ӧ���ɶ�����̼��˵�������Ȼ���B��CH3COOH��B��ͬ���칹���ܷ���������Ӧ��˵������ȩ���������Ǽ������HCOOCH3��Ҳ������CH2OHCHO��
��2��C�Ƿ��㻯�����Է�������Ϊ180����̼����������Ϊ60.0%�������������Ϊ4.4%������Ϊ������C��H��Oԭ�Ӹ���֮��=![]() =9��8��4���������ʽΪ��C9H8O4��x��x=180/(12��9+1��8+16��4)=1��д������ʽ��
=9��8��4���������ʽΪ��C9H8O4��x��x=180/(12��9+1��8+16��4)=1��д������ʽ��
������A��C11H8O4��������������Һ�м��ȷ�Ӧ�����ữ�ɵõ�������B��C��˵��A�к���������
��1��B�ķ���ʽΪC2H4O2��������ֻ��һ�������ţ�������̼�����Ʒ�Ӧ���ɶ�����̼��˵�������Ȼ�������B��CH3COOH�������̼�����Ʒ�Ӧ���������ƺ�ˮ��������̼����Ӧ����ʽΪCH3COOH+NaHCO3=CH3COONa+H2O+CO2����B��ͬ���칹���ܷ���������Ӧ��˵������ȩ���������Ǽ������HCOOCH3��Ҳ�������ǻ���ȩCH2OHCHO��
��2��C�Ƿ��㻯�����Է�������Ϊ180����̼����������Ϊ60.0%�������������Ϊ4.4%������Ϊ������C��H��Oԭ�Ӹ���֮��==![]() =9��8��4���������ʽΪ��C9H8O4��x��x=180/(12��9+1��8+16��4)=1���ݴ��жϷ���ʽΪC9H8O4��
=9��8��4���������ʽΪ��C9H8O4��x��x=180/(12��9+1��8+16��4)=1���ݴ��жϷ���ʽΪC9H8O4��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Һ�м������Na2O2�����ܴ����������
A.NH![]() ��Ba2+��Cl-��NO
��Ba2+��Cl-��NO![]() B.K+��SiO
B.K+��SiO![]() ��AlO
��AlO![]() ��SO
��SO![]()
C.Fe2+��Mg2+��SCN-��Cl-D.Na+��SO![]() ��I-��HCO
��I-��HCO![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������(�۵�1410��)�����õİ뵼����ϣ��ɴֹ��ƴ���������£�
![]()
��������SiCl4�ƴ���ķ�Ӧ�У����ÿ����1.12 kg����������a kJ������д���÷�Ӧ���Ȼ�ѧ����ʽ��_________��
��Ŀǰ��ҵ����һ�ַ�������CO2������ȼ�ϼ״���Ϊ̽���÷�Ӧԭ������������ʵ�飬�����Ϊ1L���ܱ������У�����1mol CO2��3.25 mol H2����һ�������·�����Ӧ���ⶨCO2��CH3OH(g)��H2O(g)��Ũ����ʱ��仯����ͼ��ʾ��
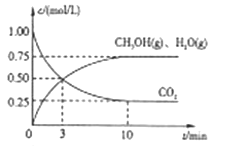
��1���ӷ�Ӧ��ʼ��ƽ�⣬������ƽ����Ӧ������(H2)��__________ ��
��2����������CO2��ת����Ϊ_______��
����ͼ��һ���Ҵ�ȼ�ϵ�ع���ʱ��ʾ��ͼ���ҳ��е������缫һ����ʯī�缫��һ�������缫������ʱM��N�����缫�������������٣���ش��������⣺

��1��M���ĵ缫����Ϊ ___________________��
��2�������Ҵ��IJ��缫�ĵ缫��ӦʽΪ___________��
��3���ڴ˹������ҳ���ijһ�缫����������4.32gʱ����ʱ�ҳ���Һ�����Ϊ400mL�����ҳ�����Һ��pHΪ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ڵ�ء��Ͻ𡢴����ȷ���Ӧ�ù㷺��
��1�����й��ڽ�������������˵����ȷ����_____��
a�����������з������뱥����
b���������ǽ��������������ɵ��Ӽ�������
c��������������Ϊ����ӵ糡�����²������ɵ���
d���������й�������Ϊ�������������ղ��ų��ɼ���
��2��Ni��Ԫ�����ڱ��е�28��Ԫ�أ��ڶ����ڻ�̬ԭ��δ�ɶԵ�������Ni��ͬ�ҵ縺����С��Ԫ����____��
��3�����˽��������Ni��CO��n������ԭ�Ӽ۵������������ṩ��������֮��Ϊ18����n=___��CO��N2�ṹ���ƣ�CO��������������������֮��Ϊ______��
��4����ȩ��H2C�TO����Ni�������¼���ɵü״���CH3OH�����״�������Cԭ�ӵ��ӻ���ʽΪ_____���״������ڵ�O��C��H����____������������������������С��������ȩ�����ڵ�O��C��H���ǣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ����
A.��Ũ�����ữ��KMnO4��Һ����H2C2O4��6H+��5H2C2O4��2MnO4-��10CO2����2Mn2+��8H2O
B.��Ca(HCO3)2��Һ�еμ�������NaOH��Һ��Ca2+��2HCO3����2OH����CaCO3����CO32����2H2O
C.��Fe(NO3)3��Һ�м��������HI��Һ��2NO3����8H+��6I����3I2��2NO����4H2O
D.��ʯī�缫���MgCl2��Һ��Mg2+��2Cl����2H2O![]() Mg(OH)2����H2����Cl2��
Mg(OH)2����H2����Cl2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����Һ����Ҫ�ɷ�ΪNaClO��������һ������NaOH����������������ʵ�ķ���ʽ�в��������ǣ���֪������NaClO��Һ��pHԼΪ11��
A. ������Һ����NaOH��Һ����Cl2�Ʊ���Cl2+2OH��="==" Cl��+ ClO��+ H2O
B. ������Һ��pHԼΪ12��ClO��+ H2O![]() HClO+ OH��
HClO+ OH��
C. ������Һ�����飨��Ҫ�ɷ�ΪHCl�����ã�����Cl2��2H��+ Cl��+ ClO��= Cl2��+H2O
D. ������Һ�Ӱ״�����HClO������ǿƯ�����ã�CH3COOH+ ClO��= HClO+CH3COO��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݻ�������ܱ������У���һ�������·�����Ӧ��2AB(g)+C(s)���Ҵﵽƽ�⣬�������¶�ʱ��������������ܶȱ���������ж���ȷ����( )
A.������ӦΪ���ȷ�Ӧ����AΪ��̬
B.������ӦΪ���ȷ�Ӧ����AΪ����̬
C.����ƽ����ϵ�м�������C�����ƽ�������ƶ�
D.���ı��¶ȣ������ƽ��Ħ���������䣬��Aһ��Ϊ����̬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йؽ����Ĺ�ҵ�Ʒ��У���ȷ����
A. �Ժ�ˮΪԭ���Ƶþ��Σ��ٵ�⾫�ε�ˮ��Һ��ȡ��
B. �ú�ˮ��ʯ�����Ϊԭ�ϣ���һϵ�й����Ƶ�����þ����H2��ԭ����þ�Ƶ�þ
C. ������ʯ����̿��������ʯ��ʯ��Ϊԭ�ϣ�ͨ����Ӧ������CO�ڸ����»�ԭ����ʯ�Ƶ���
D. ���������л�����������Ƶ��Ȼ������壬������ڵ��Ȼ����õ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
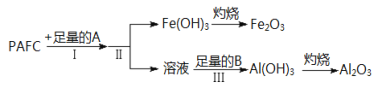
����Ŀ����.��Ч��ˮ���ۺ��Ȼ�����(PAFC)����ɿɱ�ʾΪ[AlFe(OH)nCl6��n]m�������ʹ㷺Ӧ�����ճ�������ˮ��ҵ��ˮ�Ĵ����������ʿ��������������Ӧ�Ľ��������ӡ�Ϊ���PAFC��������Ԫ�صĺ�����������ͼ��ʾ���̽��У�
�ش��������⣺
��PAFC����Ԫ�صĻ��ϼ�Ϊ_____����μ����Ԫ�صĴ���___________________
�Ʋ���I�е��Լ�A��_______________(��������������Һ��������ˮ����ѡ��)�������е��Լ�B��_____________�����ӷ���ʽ��__________
�Dz������IJ�����______________________
��. �ż�ͬѧ������������Һ���Ȼ�������Һ�Ʊ�������������������ͬѧ������������Һ�����Ȼ�������Һ�У��۲쵽��������____________����Ӧ�����з�����Ӧ�Ļ�ѧ����ʽ��_________����ͬѧͨ�����¸Ľ��Ʊ�������������
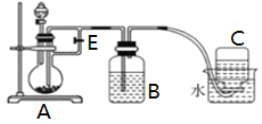
ʵ���ṩ���Լ�����м��3mol/L������Һ��NaOH��Һ����ش��������⣺
�Ƣٷ�Һ©����ʢװ���Լ���______________��Һ (����H2SO4������NaOH����ѡ��)��
��ʵ�鿪ʼʱӦ��ֹˮ��E___________ (�������������ر�����ѡ��)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com