
����Ŀ�������ǰ��ֻ�״���������ʣ�
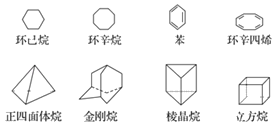
��1����Ϊͬ���칹�����___��___��___��___����д���ƣ���
��2������������Ķ���ȡ��������___�֣�������һ��ȡ��������___�֡�
��3��������A����Է�������Ϊ86������̼����������Ϊ55.8%�������������Ϊ7.0%������Ϊ����
��A�ķ���ʽΪ___��
��A�ж���ͬ���칹�壬д�����ͬʱ��������������ͬ���칹��Ľṹ��ʽ��
a���ܷ���ˮ�ⷴӦb����ʹ������Ȼ�̼��Һ��ɫ
___��___��___��___��___��
���𰸡��� �⾧�� ������ϩ ������ 1 2 C4H6O2 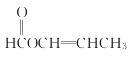
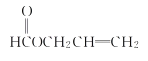
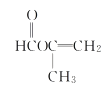

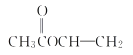
��������
��1��������ͬ����ʽ���ṹ��ͬ�Ļ����ﻥΪͬ���칹�壻
��2��������������ȫ�Գƣ�������������������ԭ�ӣ�
��3���ٸ��ݲ�ͬԭ�ӵ����������������ԭ����Ŀ��
��A�ܷ���ˮ�ⷴӦ��˵������������A��ʹ������Ȼ�̼��Һ��ɫ��˵������̼̼˫����
��1�������⾧��ķ���ʽ��ΪC6H6�����߽ṹ��ͬ����Ϊͬ���칹�壬������ϩ�����������ʽ��ΪC8H8�����߽ṹ��ͬ����Ϊͬ���칹�壬�ʴ�Ϊ�������⾧�飻������ϩ�������飻
��2��������������ȫ�Գƣ�ֻ��һ����ԭ�ӣ�һ�ȴ���ֻ��1�֣�һ�ȴ�������ԭ��Ҳֻ��1�֣����Թʶ��ȴ���ֻ��1�֣�������������������ԭ�ӣ�һ���Ǵμ��⣬һ���Ǽ��⣬������һ�ȴ�����2�֣��ʴ�Ϊ��1��2��
��3���ٻ�����A������N��C����![]() ��4��N��H����
��4��N��H����![]() ��6����N��O����
��6����N��O����![]() ��2����A�ķ���ʽΪC4H6O2���ʴ�Ϊ��C4H6O2��
��2����A�ķ���ʽΪC4H6O2���ʴ�Ϊ��C4H6O2��
��A�ܷ���ˮ�ⷴӦ��˵������������A��ʹ������Ȼ�̼��Һ��ɫ��˵������̼̼˫��������������ͬ���칹���У�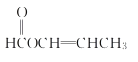 ��
��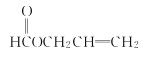 ��
�� ��
��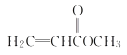 ��
��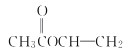 ���ʴ�Ϊ��
���ʴ�Ϊ��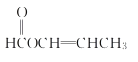 ��
��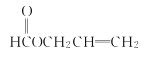 ��
��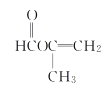 ��
��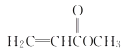 ��
��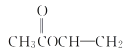 ��
��


 �������ͬ������ϵ�д�
�������ͬ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ŷ��ԭ����2012��1��1�������պ���̼��˰��Ӧ�Ա����ڻ���ȫ���ů��ʹ�ö���ν��ʹ�����CO2�ĺ�������Ч�ؿ�������̼��Դ���о��Եø��ӽ��ȡ������û�ѧ��Ӧԭ�������֪ʶ�о�̼���仯��������ʡ�
(1)���������ҹ���������̼���о�ȡ���ش��չ���õ绡���ϳɵ�̼�����г����д���̼������(����)������̼���������������������ᴿ���䷴Ӧ�Ļ�ѧ����ʽΪ��
__C+__K2Cr2O7+__��__CO2��+__K2SO4+__Cr2(SO4)3+_H2O
����ɲ���ƽ������ѧ����ʽ��
(2)�״���һ������ȼ�ϣ��״�ȼ�ϵ�ؼ�����ʵ��������ҵ����������ҵ��һ����CO��H2Ϊԭ�Ϻϳɼ״����÷�Ӧ���Ȼ�ѧ����ʽΪ��CO(g)+2H2(g)![]() CH3OH(g) ��H1=-116 kJmol-1
CH3OH(g) ��H1=-116 kJmol-1
�����д�ʩ������������÷�Ӧ�ķ�Ӧ���ʵ���___��
A.��ʱ��CH3OH�뷴Ӧ�������� B.���ͷ�Ӧ�¶�
C.������ϵѹǿ D.ʹ�ø�Ч����
����֪��CO(g)+![]() O2(g)=CO2(g) ��H2=-283 kJmol-1��
O2(g)=CO2(g) ��H2=-283 kJmol-1��
H2(g)+![]() O2(g)=H2O(g) ��H3=-242 kJmol-1
O2(g)=H2O(g) ��H3=-242 kJmol-1
���ʾ1 mol��̬�״���ȫȼ������CO2��ˮ����ʱ���Ȼ�ѧ����ʽΪ___��
�����ݻ�Ϊ1 L�ĺ��������У��ֱ��о���230�桢250���270�������¶��ºϳɼ״��Ĺ��ɡ���ͼ�����������¶��²�ͬ��H2��CO����ʼ��ɱ�(��ʼʱCO�����ʵ�����Ϊ1 mol)��COƽ��ת���ʵĹ�ϵ��

��ش�
��)�����������¶��У�����Z��Ӧ���¶���______��
��)����ͼ��a���Ӧ�����ݣ����������Z�ڶ�Ӧ�¶���CO(g)+2H2(g)![]() CH3OH(g)��ƽ�ⳣ��K=___��
CH3OH(g)��ƽ�ⳣ��K=___��
(3)CO2����Ȼ��ѭ��ʱ����CaCO3��Ӧ��CaCO3��һ���������ʣ���Ksp=2.8��10-9��CaCl2��Һ��Na2CO3��Һ��Ͽ��γ�CaCO3�������ֽ��������CaCl2��Һ��Na2CO3��Һ��ϣ���Na2CO3��Һ��Ũ��Ϊ7��10-4 mol/L�������ɳ�������CaCl2��Һ����СŨ��Ϊ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E���ֶ�����Ԫ�أ�ԭ��������������A��Eͬ���壬AԪ�ص�ԭ�Ӱ뾶��С��BԪ��ԭ�ӵ��������������ڲ��������2����CԪ�ص�����������Ӧ��ˮ����X�����⻯�ﷴӦ����һ����Y��A��B��C��E����Ԫ�ض�����DԪ���γ�ԭ�Ӹ����Ȳ���ͬ�ij��������E2D2�����ں������DZˮͧ����������Դ�������������Ϣ�ش��������⣺
(1)BD2�ĵ���ʽΪ________��
(2)EAB2D4ˮ��Һ�����Ե�ԭ����________��
(3)����Ũ�ȵ������EABD3��Һ��E2BD3��Һ��ϣ����û����Һ�и����ӵ�����Ũ���ɴ�С��˳��Ϊ____��
(4)A��B��D��E����Ԫ����ɵ�ij������������ֽ⡣д���û��������Һ��������Ba(OH)2��Һ��Ӧ�����ӷ���ʽ______��
(5)�����£����X��Y��ˮ��Һ��pH��Ϊ5��������ˮ��Һ����ˮ�������H+Ũ��֮����____��
(6)��һ��װ�п��ƶ��������ܱ������н������¿��淴Ӧ��C2(g)+3A2(g��![]() 2CA3(g)��H=��92.4 kJ/mol����Ӧ�ﵽƽ���������и����ʵ����ʵ����ֱ�ΪC2��0.5mol��A2��0.2mol��CA3��0.2 mol����ʱ�������Ϊ1.0 L����������¶Ⱥ�ѹǿ���䣬������ƽ����ϵ�м���0.18molC2��ƽ�⽫____�ƶ��������������������
2CA3(g)��H=��92.4 kJ/mol����Ӧ�ﵽƽ���������и����ʵ����ʵ����ֱ�ΪC2��0.5mol��A2��0.2mol��CA3��0.2 mol����ʱ�������Ϊ1.0 L����������¶Ⱥ�ѹǿ���䣬������ƽ����ϵ�м���0.18molC2��ƽ�⽫____�ƶ��������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��p[c(HX)/c(X-)]=-lg[c(HX)/c(X-)]�������£���0. 10 mol/LHX��Һ�еμ�0.10 mol/L NaOH��Һ����ҺpH��p[c(HX)/c(X-)]�仯��ϵ��ͼ������˵������ȷ����
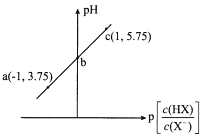
A. ��Һ��ˮ�ĵ���̶ȣ�a<b<cB. ͼ��b������Ϊ(0��4.75)
C. c����Һ�У�c(Na+) =l0c(HX)D. ������HX�ĵ��볣��Ϊ10-4. 75
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ɷ������·�Ӧ��P4+5O2=P4O10����֪�������л�ѧ����Ҫ���յ������ֱ�Ϊ��P��P akJ��mol��1��P��O bkJ��mol��1��P="O" ckJ��mol��1��O="O " dkJ��mol��1��

����ͼʾ�ķ��ӽṹ���й����ݹ���÷�Ӧ����H��������ȷ���ǣ� ��
A. ��6a+5d��4c��12b��kJ��mol��1B��4c+12b��6a��5d��kJ��mol��1 B. ��4c+12b��4a��5d��kJ��mol��1
C. ��4a+5d��4c��12b��kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��K2Cr2O7��Һ�д���ƽ�⣺Cr2O72-(��ɫ)+H2O2CrO42-(��ɫ)+2H+����K2Cr2O7��Һ��������ʵ�飺
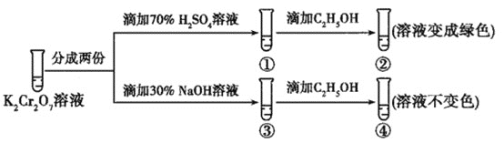
���ʵ�飬����˵������ȷ���ǣ� ��
A.������Һ��ɫ���������Һ���
B.����Cr2O72-��C2H5OH��ԭ
C.�ԱȢںܿ͢�֪K2Cr2O7������Һ������ǿ
D.������м���70%H2SO4��Һ����������Һ��Ϊ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�0.1mol��L-1��H2A��Һ�и�����Ũ�ȵĶ���ֵ(lgc)��pH�Ĺ�ϵ��ͼ��ʾ��
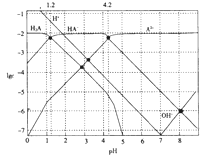
����˵������ȷ����
A. H2A�Ƕ�Ԫ����
B. HA-![]() H++A2-�ĵ���ƽ�ⳣ��Ka=10-12
H++A2-�ĵ���ƽ�ⳣ��Ka=10-12
C. 0.1mol��L-1��H2A��Һ����c(H+)=c(HA-)+2c(A2-)+c(OH-)
D. pH=4.2 ʱ��c(HA-)=c(A2-)>c(H+)>c(H2A)>c(OH-��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʽ��������������Na2SO4��ˮ��ԭ����ͼ��ʾ�����ö��Ե缫��ab��cd��Ϊ���ӽ���Ĥ����ֱ���糡�������£���Ĥ�м��Na+��SO42-��ͨ�����ӽ���Ĥ�������˸��������ӱ��赲���ܽ����м���ҡ�����������ȷ����

A. ͨ����м���ҵ�SO42-����������Ǩ�ƣ���������ҺpH����
B. �÷��ڴ�����Na2SO4��ˮʱ���Եõ�NaOH��H2SO4��Ʒ
C. ������ӦΪ2H2O�C4e�C=O2+4H+����������ҺpH����
D. ����·��ͨ��1mol���ӵĵ���ʱ������0.5mol��O2����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com