
化工生产中常利用硫酸厂煅烧黄铁矿石的烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)来制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),流程如 下:

(1)将过程②中产生的气体通入下列溶液中,溶液会褪色的是________(填选项序号)。
a.品红溶液 b.紫色石蕊溶液 c.酸性KMnO4溶液 d.溴水
(2)过程①中,FeS和O2、H2SO4反应的离子方程式为______________________
(3)过程③中,需加入的物质是____________;反应的化学方程式为_____________________
用溶液Y制绿矾时,可取少量Y溶液于试管中,向试管内加入少量的________________溶液,观察溶液是否变为________色,以验证其中是否含有Fe3+。
(4)在实验室里,完成过程④中的____________(填操作名称),需要使用酒精灯、三脚架、坩埚钳等,还需要的玻璃仪器有___________________________。
(5)过程⑥中,将溶液Z加热到70~80℃,目的是____________________________________________________。
(6)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验:①用分析天平称取2.700 g样品;②将样品溶于足量的盐酸后,加入过量的氯化钡溶液;③过滤、洗涤、干燥、称量,得固体质量为3.495 g。若该聚铁的主要成分为[Fe(OH)SO4]n,则聚铁样品中铁元素的质量分数为________。(假设杂质中不含铁元素和硫元素)
(1)acd (2)4FeS+3O2+12H+=4Fe3++6H2O+4S (3)Fe(或铁) Fe2(SO4)3+Fe=3FeSO4
硫氰化钾(或其他合理答案) 红 (4)蒸发结晶 蒸发皿、玻璃棒 (5)促进Fe3+的水解 (6)31.1 %
【解析】由题中信息可知,过程①向烧渣中加稀硫酸并同时通入氧气,铁的氧化物、硫化亚铁均会溶解,生成硫酸铁、单质硫和水,所以溶液X是硫酸铁溶液,过程②灼烧固体,其中的硫被氧化成二氧化硫。(1)二氧化硫能分别使品红溶液、酸性KMnO4溶液和溴水褪色。(2)过程①中,FeS和O2、H2SO4反应的离子方程式为4FeS+3O2+12H+=4Fe3++6H2O+4S。(3)由产物绿矾逆推可知过程③是将硫酸铁转化为硫酸亚铁的过程,应加入铁粉还原硫酸铁,有关反应的化学方程式为Fe2(SO4)3+Fe=3FeSO4。验证硫酸亚铁溶液中是否含有Fe3+,可用含SCN-的溶液检验,若溶液变为红色,证明溶液中含有Fe3+,若溶液不变色,证明溶液中不含Fe3+。(4)由硫酸亚铁溶液制绿矾,应使用蒸发结晶的方法,需要使用酒精灯、三脚架、蒸发皿、玻璃棒等。(5)过程⑥中,将硫酸铁溶液加热到70~80℃,目的是促进Fe3+的水解。(6)3.495 g的BaSO4为0.015 mol,铁元素的质量为56 g·mol-1×0.015 mol=0.840 g,所以该聚铁样品中铁元素的质量分数为(0.840/2.700)×100%=31.1 %。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题12化学实验基础练习卷(解析版) 题型:选择题
下列关于溶液中所含离子的检验结论正确的是( )。
A.加入氨水时生成白色沉淀,当氨水过量时白色沉淀消失,则原溶液中一定有Al3+存在
B.欲鉴别FeCl2溶液、AlCl3溶液和AgNO3溶液,向3种待测液中分别滴加足量氨水
C.加入盐酸,有能使澄清石灰水变浑浊的气体生成,则原溶液中一定有大量的CO32—存在
D.加入BaCl2溶液生成白色沉淀,再加足量盐酸沉淀不溶解,则原溶液中一定有SO42—存在
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮冲刺非选择题增分专练 综合实验设计练习卷(解析版) 题型:实验题
某研究小组利用如图装置探究温度对CO还原Fe2O3的影响(固定装置略)。

(1)MgCO3的分解产物为________。
(2)装置C的作用是_____________________________________________________,
处理尾气的方法为_______________________________________________________。
(3)将研究小组分为两组,按如图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置D加热,反应产物均为黑色粉末(纯净物)。两组分别用产物进行以下实验:
(已知:Fe2+与K3[Fe(CN)6]反应产生蓝色沉淀)。
步骤 | 操作 | 甲组现象 | 乙组现象 |
1 | 取黑色粉末加入稀盐酸 | 溶解,无气泡 | 溶解,有气泡 |
2 | 取步骤1中溶液,滴加K3[Fe(CN)6]溶液 | 蓝色沉淀 | 蓝色沉淀 |
3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 |
4 | 向步骤3溶液中滴加新制氯水 | 红色褪去 | 先变红,后褪色 |
①乙组得到的黑色粉末是________。
②甲组步骤1中反应的离子方程式为__________________________________________。
③乙组步骤4中,溶液变红的原因为_______________________________________,
溶液褪色可能的原因及其验证方法为______________________________________
④从实验安全考虑,题图装置还可采取的改进措施是__________________________
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮冲刺非选择题增分专练 基本概念、基本理论练习卷(解析版) 题型:填空题
煤直接燃烧的能量利用率较低,为提高其利用率,工业上将煤气化(转变成CO和H2)后再合成乙醇、二甲醚等多种能源。
(1)如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。该电池的负极反应式为______________________。

(2)煤气化所得气体可用于工业合成二甲醚,其反应如下:
2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)。
CH3OCH3(g)+H2O(g)。
同时发生副反应:CO(g)+2H2(g) CH3OH(g);CO(g)+H2O(g)??CO2(g)+H2(g)。
CH3OH(g);CO(g)+H2O(g)??CO2(g)+H2(g)。
在温度为250 ℃、压强为3.0 MPa时,某工厂按投料比V(H2)∶V(CO) =a进行生产,平衡时反应体系中各组分的体积分数如下表:
物质 | H2 | CO | CO2 | (CH3)2O | CH3OH(g) | H2O(g) |
体积分数 | 0.54 | 0.045 | 0.18 | 0.18 | 0.015 | 0.03 |
①投料比a=________;
②250℃时反应CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数K=________。
CO2(g)+H2(g)的平衡常数K=________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮冲刺非选择题增分专练 化学工艺流程练习卷(解析版) 题型:填空题
随着能源问题的进一步突出,利用热化学循环制氢的研究受到许多发达国家的青睐。最近的研究发现,复合氧化物铁酸锰(MnFe2O4)也可以用于热化学循环分解水制氢,MnFe2O4的制备流程如下:

(1)原料Fe(NO3)n中n=________,投入原料Fe(NO3)n和Mn(NO3)2的物质的量之比应为________。
(2)步骤二中“连续搅拌”的目的是__________________________________________
步骤三中洗涤干净的标准是________________________________________________
(3)利用MnFe2O4热化学循环制氢的反应可表示为:
MnFe2O4 MnFe2O4-x+O2↑;
MnFe2O4-x+O2↑;
MnFe2O4-x+xH2O MnFe2O4+xH2↑
MnFe2O4+xH2↑
请认真分析上述两个反应并回答下列问题:
①若MnFe2O4-x中x=0.8,则MnFe2O4-x中Fe2+占全部铁元素的百分率为________。
②该热化学循环制氢法的优点有_____________________、________________________ (答两点即可)。
该热化学循环法制氢尚有不足之处,进一步改进的研究方向是___________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮冲刺选择题限时提速专练 定量分析练习卷(解析版) 题型:选择题
某铅酸蓄电池的工作原理如图所示,其总反应式为Pb+PbO2+2H2SO4=2PbSO4+2H2O。下列判断不正确的是( )
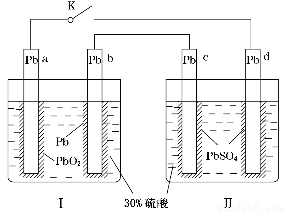
A.闭合K时,d电极的反应式为PbSO4+2H2O-2e-=PbO2+4H++SO42—
B.当电路中转移0.2 mol电子时,Ⅰ中消耗的H2SO4为0.2 mol
C.闭合K时,Ⅱ中SO42—向c电极迁移
D.闭合K一段时间后,Ⅱ可单独作为原电池,d电极为正极
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮冲刺选择题限时提速专练 定量分析练习卷(解析版) 题型:选择题
25℃时,某难溶性碱MOH在水中的沉淀溶解平衡曲线如图所示(单位:mol·L-1)。下列说法正确的是( )

A.该碱在25℃时的Ksp为2×10-10
B.a点的Ksp大于b点的Ksp
C.通过蒸发可使溶液由b点变为c点
D.25℃时,要使c(M+)为0.1 mol·L-1的溶液形成沉淀,溶液的pH至少要升高到5
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题复习 离子反应、氧化还原反应练习卷(解析版) 题型:填空题
亚硝酸(HNO2)是一种与醋酸酸性相当的弱酸,很不稳定,通常在室温下立即分解。
(1)写出亚硝酸的电离方程式: 。
(2)在酸性条件下,当NaNO2与KI按物质的量之比1∶1恰好完全反应,且I-被氧化为I2时,产物中含氮的物质为 (填化学式)。
(3)要得到稳定的HNO2溶液,可以向冷冻的NaNO2浓溶液中加入或通入某种物质,下列物质不适合的是 (填字母)。
a.稀硫酸 b.二氧化碳 c.二氧化硫 d.磷酸
(4)碱性工业废水中的N 可用铝粉除去。已知此反应体系中含有Al、NaAlO2、NaNO2、NaOH、NH3·H2O、H2O六种物质。
可用铝粉除去。已知此反应体系中含有Al、NaAlO2、NaNO2、NaOH、NH3·H2O、H2O六种物质。
①写出上述反应的离子方程式: 。
②发生上述反应后废水的pH将 (填“增大”“减小”或“不变”)。
(5)酸性工业废水中的N 可用尿素除去。尿素
可用尿素除去。尿素
( )与N
)与N 在酸性条件下反应生成两种无毒气体。该反应中生成16.8 L(已折算为标准状况)混合气体时,消耗尿素的质量为 g。
在酸性条件下反应生成两种无毒气体。该反应中生成16.8 L(已折算为标准状况)混合气体时,消耗尿素的质量为 g。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题复习 物质结构和元素周期律练习卷(解析版) 题型:选择题
目前人类已发现的非金属元素除稀有气体外共有16种,对这16种非金属元素的相关判断( )
①都是主族元素,最外层电子数都大于4
②单质在反应中都只能作氧化剂
③氢化物常温下都是气态,所以又叫作气态氢化物
④氧化物常温下都可以与水反应生成酸
⑤根据非金属原子最外层的电子数,可判断两种元素得电子能力的强弱
⑥非金属得电子后形成的简单阴离子的核外电子排布一定与上一周期稀有气体原子的核外电子排布相同
A.④⑤正确B.①③⑥正确C.②③⑤正确D.都错误
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com