
某铅酸蓄电池的工作原理如图所示,其总反应式为Pb+PbO2+2H2SO4=2PbSO4+2H2O。下列判断不正确的是( )
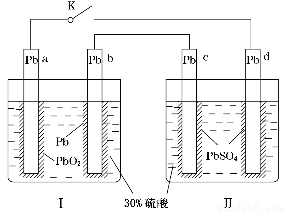
A.闭合K时,d电极的反应式为PbSO4+2H2O-2e-=PbO2+4H++SO42—
B.当电路中转移0.2 mol电子时,Ⅰ中消耗的H2SO4为0.2 mol
C.闭合K时,Ⅱ中SO42—向c电极迁移
D.闭合K一段时间后,Ⅱ可单独作为原电池,d电极为正极
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题12化学实验基础练习卷(解析版) 题型:选择题
实验是化学研究的基础,下列各图所示的实验方法、装置或操作正确的是 ( )

查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮冲刺非选择题增分专练 有机推断练习卷(解析版) 题型:推断题
某吸水材料与聚酯纤维都是重要的化工原料。它们的合成路线如图所示:

已知: ①A由C、H、O三种元素组成,相对分子质量为32。
②RCOOR′+R″OH RCOOR″+R′OH(R、R′、R″代表烃基)。
RCOOR″+R′OH(R、R′、R″代表烃基)。
请回答下列问题:
(1)A的结构简式是____________________。
(2)B中的官能团名称是______________________。
(3)D→E的反应类型是______________。
(4)①乙酸与化合物M反应的化学方程式是_________________________________
②G→聚酯纤维的化学方程式是____________________________
(5)E的名称是___________。
(6)G的同分异构体有多种,满足下列条件的共有_____种。
①苯环上只有两个取代基;
②1 mol该物质与足量的NaHCO3溶液反应生成2 mol CO2。
(7)写出由 合成
合成 的流程图(注明反应条件)。
的流程图(注明反应条件)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮冲刺非选择题增分专练 图像、图表练习卷(解析版) 题型:实验题
酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法,其中溶液的pH变化是判断滴定终点的依据。

(1)为了准确绘制上图,在滴定开始时和________,滴液速度可以稍快一点,测试和记录pH的间隔可大些;当接近________时,滴液速度应该慢一些,尽量每滴一滴就测试一次。
(2)在图中A的pH范围使用的指示剂是____________;C的pH范围使用的指示剂是________________;D区域为________________。
(3)用0.1 032 mol·L-1的盐酸溶液滴定未知浓度的氢氧化钠溶液,重复三次的实验数据如下表所示:
实验序号 | 消耗0.1 032 mol·L-1的盐酸溶液的体积/mL | 待测氢氧化钠溶液的体积/mL |
1 | 28.84 | 25.00 |
2 | 27.83 | 25.00 |
3 | 27.85 | 25.00 |
则待测氢氧化钠的物质的量浓度是________mol·L-1。在上述滴定过程中,若滴定前滴定管下端尖嘴中有气泡,滴定后气泡消失,则测定结果将________(填“偏高”、“偏低”或“不影响”)。
(4)下列关于上述中和滴定过程中的操作正确的是________(填字母)。
A.用碱式滴定管量取未知浓度的烧碱溶液
B.滴定管和锥形瓶都必须用待盛放液润洗
C.滴定中始终注视锥形瓶中溶液颜色变化
D.锥形瓶中的待测液可用量简量取
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮冲刺非选择题增分专练 化学工艺流程练习卷(解析版) 题型:填空题
化工生产中常利用硫酸厂煅烧黄铁矿石的烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)来制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),流程如 下:

(1)将过程②中产生的气体通入下列溶液中,溶液会褪色的是________(填选项序号)。
a.品红溶液 b.紫色石蕊溶液 c.酸性KMnO4溶液 d.溴水
(2)过程①中,FeS和O2、H2SO4反应的离子方程式为______________________
(3)过程③中,需加入的物质是____________;反应的化学方程式为_____________________
用溶液Y制绿矾时,可取少量Y溶液于试管中,向试管内加入少量的________________溶液,观察溶液是否变为________色,以验证其中是否含有Fe3+。
(4)在实验室里,完成过程④中的____________(填操作名称),需要使用酒精灯、三脚架、坩埚钳等,还需要的玻璃仪器有___________________________。
(5)过程⑥中,将溶液Z加热到70~80℃,目的是____________________________________________________。
(6)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验:①用分析天平称取2.700 g样品;②将样品溶于足量的盐酸后,加入过量的氯化钡溶液;③过滤、洗涤、干燥、称量,得固体质量为3.495 g。若该聚铁的主要成分为[Fe(OH)SO4]n,则聚铁样品中铁元素的质量分数为________。(假设杂质中不含铁元素和硫元素)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮冲刺选择题限时提速专练 定量分析练习卷(解析版) 题型:选择题
C和CuO在高温下反应可能生成Cu、Cu2O、CO2、CO。现将1 g碳粉跟8 g CuO混合,在硬质试管中隔绝空气高温加热,将生成的气体全部通入足量NaOH溶液中,并收集残余的气体,测得溶液增加的质量为1.1 g,残余气体在标准状况下的体积为560 mL。下列说法错误的是( )
A.在硬质试管中隔绝空气高温加热固体混合物时,有0.6 g碳参加了反应
B.试管中发生的所有氧化还原反应共转移电子0.15 mol
C.反应后试管中剩余的固体混合物的总质量为7.2 g
D.反应生成铜和氧化亚铜的总物质的量为0.1 mol
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题复习物质的组成分类及能量变化练习卷(解析版) 题型:计算题
我国是个钢铁大国,钢铁产量居世界第一位,高炉炼铁是最为普遍的炼铁方法。某种矿石中铁元素以氧化物FemOn的形式存在,现进行如下实验:将少量铁矿石样品粉碎,称取25.0 g样品于烧杯中,加入稀硫酸充分溶解,并不断加热、搅拌,滤去不溶物。向所得滤液中加入10.0 g铜粉充分反应后过滤、洗涤、干燥得剩余固体3.6 g。剩下滤液用2 mol·L-1的酸性KMnO4滴定,至终点时消耗KMnO4溶液体积25.0 mL。
(1)计算该铁矿石中铁元素的质量分数。
(2)计算氧化物FemOn的化学式(m、n为正整数)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题复习 离子反应、氧化还原反应练习卷(解析版) 题型:选择题
下列所述事实与化学(或离子)方程式不相符的是( )
A.能说明氧化性H2O2>Fe3+:2Fe2++H2O2+2H+ 2Fe3++2H2O
2Fe3++2H2O
B.能说明NH3结合H+能力比H2O强:NH3+H3O+ N
N +H2O
+H2O
C.能说明盐酸是强酸:2HCl+CaCO3 CaCl2+CO2↑+H2O
CaCl2+CO2↑+H2O
D.能说明CH3COOH是弱电解质:CH3COO-+H2O CH3COOH+OH-
CH3COOH+OH-
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题复习 物质结构与性质(选修3)练习卷(解析版) 题型:填空题
太阳能电池的发展已经进入了第三代。第三代就是铜铟镓硒CIGS等化合物薄膜太阳能电池以及薄膜Si系太阳能电池。完成下列填空:
(1)亚铜离子(Cu+)基态时的电子排布式为 。
(2)硒为第4周期元素,相邻的元素有砷和溴,则3种元素的第一电离能从大到小顺序为 (用元素符号表示),用原子结构观点加以解释 。
(3)与镓元素处于同一主族的硼元素具有缺电子性(价电子数少于价层轨道数),其化合物可与具有孤对电子的分子或离子生成加合物,如BF3能与NH3反应生成BF3·NH3。BF3·NH3中B原子的杂化轨道类型为 ,B与N之间形成 键。

(4)单晶硅的结构与金刚石相似,若将金刚石晶体中一半的C原子换成Si原子且同种原子不成键,则得上图所示的金刚砂(SiC)结构;在SiC中,每个C原子周围最近的C原子数目为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com