
C和CuO在高温下反应可能生成Cu、Cu2O、CO2、CO。现将1 g碳粉跟8 g CuO混合,在硬质试管中隔绝空气高温加热,将生成的气体全部通入足量NaOH溶液中,并收集残余的气体,测得溶液增加的质量为1.1 g,残余气体在标准状况下的体积为560 mL。下列说法错误的是( )
A.在硬质试管中隔绝空气高温加热固体混合物时,有0.6 g碳参加了反应
B.试管中发生的所有氧化还原反应共转移电子0.15 mol
C.反应后试管中剩余的固体混合物的总质量为7.2 g
D.反应生成铜和氧化亚铜的总物质的量为0.1 mol
D
【解析】NaOH溶液增加的质量就是反应生成二氧化碳的质量,残余气体就是一氧化碳。n(CO2)=1.1/44=0.025 mol,n(CO)=0.56/22.4=0.025 mol,则有0.05 mol碳参与了反应,参与反应的碳的质量为0.6 g。生成0.025 mol CO2转移0.1 mol电子,生成0.025 mol CO转移0.05 mol电子,反应中一共转移0.15 mol电子。反应中氧化铜失去的氧元素的质量为(0.025 mol×2+0.025 mol)×16 g/mol=1.2 g,反应后试管中剩余的固体混合物包括铜及其化合物和剩余的碳,总质量为8 g-1.2 g+1 g-0.6 g=7.2 g。设反应后生成铜和氧化亚铜的物质的量分别为x、y,根据电子得失守恒原理得:2x+2y=0.15 mol,则x+y=0.075 mol,反应生成铜和氧化亚铜的总物质的量为0.075 mol。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题12化学实验基础练习卷(解析版) 题型:选择题
“封管实验”具有简易、方便、节约、绿色等优点,观察下列四个“封管实验”(夹持装置未画出),判断下列说法正确的是
( )。

A.加热时,a上部聚集了固体NH4Cl,说明NH4Cl的热稳定性比较好
B.加热时,发现b中I2变为紫色蒸气,在上部又聚集为紫黑色的固体
C.加热时,c中溶液红色变深,冷却后又变浅
D.e内气体颜色变浅,d内气体颜色加深
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮冲刺非选择题增分专练 有机推断练习卷(解析版) 题型:填空题
已知:
为合成某种液晶材料的中间体M,有人提出如下不同的合成途径:

(1)常温下,下列物质能与A发生反应的有________(填序号)。
a.苯 b.Br2/CCl4 c.乙酸乙酯 d.KMnO4/H+溶液
(2)M中官能团的名称是________,由C→B的反应类型为________。
(3)由A催化加氢生成M的过程中,可能有中间生成物 和________(写结构简式)生成
和________(写结构简式)生成
(4)检验B中是否含有C可选用的试剂是________(任写一种名称)。
(5)物质B也可由C10H13Cl与NaOH水溶液共热生成,C10H13Cl的结构简式为________。
(6)C的一种同分异构体E具有如下特点:
a.分子中含—OCH2CH3
b.苯环上只有两种化学环境不同的氢原子
写出E在一定条件下发生加聚反应的化学方程式:____________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮冲刺非选择题增分专练 化学工艺流程练习卷(解析版) 题型:填空题
工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下:

已知:Cu2O+2H+=Cu+Cu2++H2O
(1)实验操作Ⅰ的名称为________;在空气中灼烧固体混合物D时,用到多种硅酸盐质的仪器,除玻璃棒、酒精灯、泥三角外,还有________(填仪器名称)。
(2)滤液A中铁元素的存在形式为________(填离子符号),生成该离子的离子方程式为__________________,检验滤液A中存在该离子的试剂为________(填试剂名称)。
(3)金属单质E与固体混合物F发生的某一反应可用于焊接钢轨,该反应的化学方程式为_______________________________________________。
(4)常温下,等pH的NaAlO2和NaOH两份溶液中,由水电离出的c(OH-)前者为后者的108倍。则两种溶液的pH=________。
(5)①利用电解法进行粗铜精炼时,下列叙述正确的是________(填代号)。
a.电能全部转化为化学能
b.粗铜接电源正极,发生氧化反应
c.精铜作阴极,电解后电解液中Cu2+浓度减小
d.粗铜精炼时通过的电量与阴极析出铜的量无确定关系
②从浓硫酸、浓硝酸、蒸馏水中选用合适的试剂,测定粗 铜样品中金属铜的质量分数,涉及的主要步骤:称取一定质量的样品→________________→过滤、洗涤、干燥→称量剩余固体铜的质量。(填缺少的操作步骤,不必描述操作过程的细节)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮冲刺选择题限时提速专练 定量分析练习卷(解析版) 题型:选择题
某铅酸蓄电池的工作原理如图所示,其总反应式为Pb+PbO2+2H2SO4=2PbSO4+2H2O。下列判断不正确的是( )
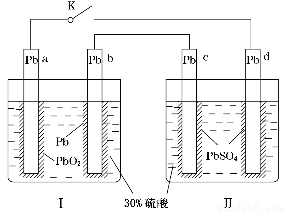
A.闭合K时,d电极的反应式为PbSO4+2H2O-2e-=PbO2+4H++SO42—
B.当电路中转移0.2 mol电子时,Ⅰ中消耗的H2SO4为0.2 mol
C.闭合K时,Ⅱ中SO42—向c电极迁移
D.闭合K一段时间后,Ⅱ可单独作为原电池,d电极为正极
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮冲刺选择题限时提速专练 定量分析练习卷(解析版) 题型:选择题
25 ℃时,在浓度均为0.01 mol·L-1的NaCN与HCN组成的混合溶液中,测得c(Na+)>c(CN-),则下列描述中不正确的是( )
A.该溶液的pH<7
B.CN-的水解程度大于HCN的电离程度
C.c(CN-)+c(HCN)=0.02 mol·L-1
D.c(CN-)+c(OH-)=0.01 mol·L-1+c(H+)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题复习物质的组成分类及能量变化练习卷(解析版) 题型:选择题
下列有关化学实验的描述中正确的是( )
A.将40 g NaOH溶于1 L蒸馏水中,该溶液的物质的量浓度为1 mol·L-1
B.配制一定物质的量浓度的NaCl溶液,如果NaCl固体中含有Na2CO3,所配制溶液中c(Na+)将偏低
C.将2.5 g CuSO4·5H2O溶解在97.5 g水中,配制质量分数为2.5%的CuSO4溶液
D.把200 mL 3 mol·L-1的BaCl2溶液跟100 mL 3 mol·L-1的KCl溶液混合后,溶液中c(Cl-)=5 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题复习 电解质溶液与电离平衡练习卷(解析版) 题型:填空题
Ⅰ.已知:H2A的A2-可表示S2-、S 、S
、S 、Si
、Si 或C
或C 等离子。
等离子。
(1)常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1 NaOH溶液。有关微粒物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。请根据图示填空:

①当V(NaOH)=20 mL时,溶液中离子浓度大小关系: 。
②等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水 (填“大”“小”或“相等”),欲使NaHA溶液呈中性,可以向其中加入 。
(2)若H2A为硫酸:t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数KW= 。
Ⅱ.已知:在25 ℃时 H2O H++OH- KW=10-14
H++OH- KW=10-14
CH3COOH H++CH3COO- Ka=1.8×10-5
H++CH3COO- Ka=1.8×10-5
(3)醋酸钠水解的平衡常数Kh的表达式为 ,具体数值= ,当升高温度时,Kh将 (填“增大”“减小”或“不变”)。
(4)0.5 mol·L-1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)为a;1 mol·L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为 ,a与b的关系为 。(填“大于”“小于”或“等于”)
Ⅲ.(5)25 ℃时,将a mol·L-1的氨水与b mol·L-1盐酸等体积混合,反应后溶液恰好显中性,则a b(填“大于”“小于”或“等于”)。用a、b表示NH3·H2O的电离平衡常数为 。
b(填“大于”“小于”或“等于”)。用a、b表示NH3·H2O的电离平衡常数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com