
酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法,其中溶液的pH变化是判断滴定终点的依据。

(1)为了准确绘制上图,在滴定开始时和________,滴液速度可以稍快一点,测试和记录pH的间隔可大些;当接近________时,滴液速度应该慢一些,尽量每滴一滴就测试一次。
(2)在图中A的pH范围使用的指示剂是____________;C的pH范围使用的指示剂是________________;D区域为________________。
(3)用0.1 032 mol·L-1的盐酸溶液滴定未知浓度的氢氧化钠溶液,重复三次的实验数据如下表所示:
实验序号 | 消耗0.1 032 mol·L-1的盐酸溶液的体积/mL | 待测氢氧化钠溶液的体积/mL |
1 | 28.84 | 25.00 |
2 | 27.83 | 25.00 |
3 | 27.85 | 25.00 |
则待测氢氧化钠的物质的量浓度是________mol·L-1。在上述滴定过程中,若滴定前滴定管下端尖嘴中有气泡,滴定后气泡消失,则测定结果将________(填“偏高”、“偏低”或“不影响”)。
(4)下列关于上述中和滴定过程中的操作正确的是________(填字母)。
A.用碱式滴定管量取未知浓度的烧碱溶液
B.滴定管和锥形瓶都必须用待盛放液润洗
C.滴定中始终注视锥形瓶中溶液颜色变化
D.锥形瓶中的待测液可用量简量取
(1)滴定终点后 滴定终点 (2)酚酞 甲基橙 pH突变范围 (3)0.114 9 偏高 (4)AC
【解析】(1)由图像可知,天始时和结束时溶液pH变化都不大,所以可以快一点;而在滴定终点附近,溶液的pH变化非常快非常大,所以要慢一点。(2)A区域的pH范围内溶液显碱性,应选择酚酞等碱性范围内变色的指示剂;C区域的pH范围内溶液显酸性,应选择甲基橙等酸性范围内变色的指示剂。而D区域内消耗的试剂的体积很小,但是溶液pH变化非常大,是滴定终点前后pH的突变范围。(3)第一组数据明显偏大,超出误差允许范围,必须舍弃,所以25.00 mL氢氧化钠溶液平均消耗27.84 mL盐酸。c(NaOH)=27.84 mL×0.103 2 mol·L-1÷25.00 mL=0.114 9 mol·L-1。若滴定前滴定管下端尖嘴中有气泡,滴定后气泡消失,则测的盐酸体积增大,计算结果将偏高。(4)中和滴定是准确测定溶液浓度的方法,所量液体的体积都要准确,所以A正确、D错误。B项滴定管一定要润洗,否则所装液体会被稀释,浓度变小。锥形瓶一定不能润洗,否则锥形瓶中所装液体的物质的量会增大,测量结果不正确,错误。C项滴定过程中应该始终注视锥形瓶中溶液颜色变化,及时判断出滴定终点并关闭活塞,正确。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题13化学实验综合应用练习卷(解析版) 题型:实验题
硫酸铜受热分解生成氧化铜和气体,加热温度不同,气体成分也不同。气体成分可能含SO2、SO3和O2中的一种、两种或三种。某化学课外活动小组通过设计探究性实验,测定反应产生的SO2、SO3和O2的物质的量,并计算确定各物质的化学计量数,从而确定CuSO4分解的化学方程式。实验用到的仪器如下图所示:

[提出猜想]
Ⅰ.所得气体的成分可能只含SO3一种;
Ⅱ.所得气体的成分可能含有________两种;
Ⅲ.所得气体的成分可能含有________三种。
[实验探究]
实验操作过程略。已知实验结束时,硫酸铜完全分解。
(1)请你组装探究实验的装置,按从左至右的方向,各仪器接口的连接顺序为①→⑨→⑩→⑥→⑤→________→________→________→________→②(填接口序号)。
(2)若实验结束时B中量筒没有收集到水,则证明猜想________正确。
(3)有两个实验小组进行该实验,由于加热时的温度不同,实验结束后测得相关数据也不同,数据如下:
实验小组 | 称取CuSO4的质量/g | 装置C增加的质量/g | 量筒中水的体积折算成标准状况下气体的体积/mL |
一 | 6.4 | 2.56 | 448 |
二 | 6.4 | 2.56 | 224 |
请通过计算,推断出第一小组和第二小组的实验条件下CuSO4分解的化学方程式。
第一小组:______________________________________________;
第二小组:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题10常见非金属元素及其重要化合物练习卷(解析版) 题型:选择题
下列与实验相关的叙述正确的是( )。
A.稀释浓硫酸时,应将蒸馏水沿玻璃棒缓慢注入浓硫酸中
B.将SO2和Cl2按等物质的量比通入品红溶液中,品红很快褪色
C.NO2与H2O反应的过程中,被氧化的氮原子与被还原的氮原子的个数比为2∶1
D.检验某溶液是否含有SO42—时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮冲刺非选择题增分专练 有机推断练习卷(解析版) 题型:填空题
已知:
为合成某种液晶材料的中间体M,有人提出如下不同的合成途径:

(1)常温下,下列物质能与A发生反应的有________(填序号)。
a.苯 b.Br2/CCl4 c.乙酸乙酯 d.KMnO4/H+溶液
(2)M中官能团的名称是________,由C→B的反应类型为________。
(3)由A催化加氢生成M的过程中,可能有中间生成物 和________(写结构简式)生成
和________(写结构简式)生成
(4)检验B中是否含有C可选用的试剂是________(任写一种名称)。
(5)物质B也可由C10H13Cl与NaOH水溶液共热生成,C10H13Cl的结构简式为________。
(6)C的一种同分异构体E具有如下特点:
a.分子中含—OCH2CH3
b.苯环上只有两种化学环境不同的氢原子
写出E在一定条件下发生加聚反应的化学方程式:____________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮冲刺非选择题增分专练 基本概念、基本理论练习卷(解析版) 题型:填空题
煤直接燃烧的能量利用率较低,为提高其利用率,工业上将煤气化(转变成CO和H2)后再合成乙醇、二甲醚等多种能源。
(1)如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。该电池的负极反应式为______________________。

(2)煤气化所得气体可用于工业合成二甲醚,其反应如下:
2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)。
CH3OCH3(g)+H2O(g)。
同时发生副反应:CO(g)+2H2(g) CH3OH(g);CO(g)+H2O(g)??CO2(g)+H2(g)。
CH3OH(g);CO(g)+H2O(g)??CO2(g)+H2(g)。
在温度为250 ℃、压强为3.0 MPa时,某工厂按投料比V(H2)∶V(CO) =a进行生产,平衡时反应体系中各组分的体积分数如下表:
物质 | H2 | CO | CO2 | (CH3)2O | CH3OH(g) | H2O(g) |
体积分数 | 0.54 | 0.045 | 0.18 | 0.18 | 0.015 | 0.03 |
①投料比a=________;
②250℃时反应CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数K=________。
CO2(g)+H2(g)的平衡常数K=________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮冲刺非选择题增分专练 化学工艺流程练习卷(解析版) 题型:填空题
工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下:

已知:Cu2O+2H+=Cu+Cu2++H2O
(1)实验操作Ⅰ的名称为________;在空气中灼烧固体混合物D时,用到多种硅酸盐质的仪器,除玻璃棒、酒精灯、泥三角外,还有________(填仪器名称)。
(2)滤液A中铁元素的存在形式为________(填离子符号),生成该离子的离子方程式为__________________,检验滤液A中存在该离子的试剂为________(填试剂名称)。
(3)金属单质E与固体混合物F发生的某一反应可用于焊接钢轨,该反应的化学方程式为_______________________________________________。
(4)常温下,等pH的NaAlO2和NaOH两份溶液中,由水电离出的c(OH-)前者为后者的108倍。则两种溶液的pH=________。
(5)①利用电解法进行粗铜精炼时,下列叙述正确的是________(填代号)。
a.电能全部转化为化学能
b.粗铜接电源正极,发生氧化反应
c.精铜作阴极,电解后电解液中Cu2+浓度减小
d.粗铜精炼时通过的电量与阴极析出铜的量无确定关系
②从浓硫酸、浓硝酸、蒸馏水中选用合适的试剂,测定粗 铜样品中金属铜的质量分数,涉及的主要步骤:称取一定质量的样品→________________→过滤、洗涤、干燥→称量剩余固体铜的质量。(填缺少的操作步骤,不必描述操作过程的细节)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮冲刺选择题限时提速专练 定量分析练习卷(解析版) 题型:选择题
某铅酸蓄电池的工作原理如图所示,其总反应式为Pb+PbO2+2H2SO4=2PbSO4+2H2O。下列判断不正确的是( )
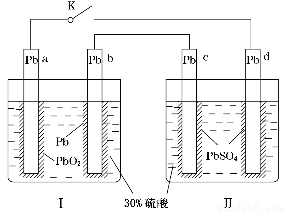
A.闭合K时,d电极的反应式为PbSO4+2H2O-2e-=PbO2+4H++SO42—
B.当电路中转移0.2 mol电子时,Ⅰ中消耗的H2SO4为0.2 mol
C.闭合K时,Ⅱ中SO42—向c电极迁移
D.闭合K一段时间后,Ⅱ可单独作为原电池,d电极为正极
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题复习物质的组成分类及能量变化练习卷(解析版) 题型:选择题
下列有关化学实验的描述中正确的是( )
A.将40 g NaOH溶于1 L蒸馏水中,该溶液的物质的量浓度为1 mol·L-1
B.配制一定物质的量浓度的NaCl溶液,如果NaCl固体中含有Na2CO3,所配制溶液中c(Na+)将偏低
C.将2.5 g CuSO4·5H2O溶解在97.5 g水中,配制质量分数为2.5%的CuSO4溶液
D.把200 mL 3 mol·L-1的BaCl2溶液跟100 mL 3 mol·L-1的KCl溶液混合后,溶液中c(Cl-)=5 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题复习 物质结构和元素周期律练习卷(解析版) 题型:填空题
X、Y、Z、W、R是元素周期表前四周期中的常见元素,其相关信息如下表:
元素 | 相关信息 |
X | 组成蛋白质的基础元素,其最高正化合价与最低负化合价的代数和为2 |
Y | 地壳中含量最高的元素 |
Z | 存在质量数为23,中子数为11的核素 |
W | 生活中大量使用其合金制品,工业上可用电解熔融氧化物的方法制备其单质 |
R | 有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
(1)W在元素周期表中的位置为 ;X、Y、Z、W四种元素的原子半径从大到小的顺序是 (用元素符号表示)。
(2)X与氢两元素按原子数目比1∶3和2∶4构成分子A和B,A的结构式为 ;B的电子式为 。化合物ZY中存在的化学键类型为 。
(3)砷(As)是人体必需的微量元素,与X同一主族,As原子比X原子多两个电子层,则砷的原子序数为 ,其最高价氧化物对应的水化物的化学式为 。该族二、三、四周期元素的气态氢化物的稳定性从大到小的顺序是 (用化学式表示)。
(4)用RCl3溶液腐蚀铜线路板的离子方程式为 。检验溶液中R3+常用的试剂是 ,可以观察到的现象是 。
(5)Z W合金(Z17W12)是一种潜在的贮氢材料,由Z、W单质在一定条件下熔炼而成。该合金在一定条件下完全吸氢的反应方程式为:Z17W12+17H2
W合金(Z17W12)是一种潜在的贮氢材料,由Z、W单质在一定条件下熔炼而成。该合金在一定条件下完全吸氢的反应方程式为:Z17W12+17H2 17ZH2+12W,得到的混合物Q(17ZH2+12W)在6.0 mol·L-1 HCl溶液中能完全释放出H2。1 mol Z17W12完全吸氢后得到的混合物Q与上述盐酸完全反应,释放出H2的物质的量为 。
17ZH2+12W,得到的混合物Q(17ZH2+12W)在6.0 mol·L-1 HCl溶液中能完全释放出H2。1 mol Z17W12完全吸氢后得到的混合物Q与上述盐酸完全反应,释放出H2的物质的量为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com