
X、Y、Z、W、R是元素周期表前四周期中的常见元素,其相关信息如下表:
元素 | 相关信息 |
X | 组成蛋白质的基础元素,其最高正化合价与最低负化合价的代数和为2 |
Y | 地壳中含量最高的元素 |
Z | 存在质量数为23,中子数为11的核素 |
W | 生活中大量使用其合金制品,工业上可用电解熔融氧化物的方法制备其单质 |
R | 有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
(1)W在元素周期表中的位置为 ;X、Y、Z、W四种元素的原子半径从大到小的顺序是 (用元素符号表示)。
(2)X与氢两元素按原子数目比1∶3和2∶4构成分子A和B,A的结构式为 ;B的电子式为 。化合物ZY中存在的化学键类型为 。
(3)砷(As)是人体必需的微量元素,与X同一主族,As原子比X原子多两个电子层,则砷的原子序数为 ,其最高价氧化物对应的水化物的化学式为 。该族二、三、四周期元素的气态氢化物的稳定性从大到小的顺序是 (用化学式表示)。
(4)用RCl3溶液腐蚀铜线路板的离子方程式为 。检验溶液中R3+常用的试剂是 ,可以观察到的现象是 。
(5)Z W合金(Z17W12)是一种潜在的贮氢材料,由Z、W单质在一定条件下熔炼而成。该合金在一定条件下完全吸氢的反应方程式为:Z17W12+17H2
W合金(Z17W12)是一种潜在的贮氢材料,由Z、W单质在一定条件下熔炼而成。该合金在一定条件下完全吸氢的反应方程式为:Z17W12+17H2 17ZH2+12W,得到的混合物Q(17ZH2+12W)在6.0 mol·L-1 HCl溶液中能完全释放出H2。1 mol Z17W12完全吸氢后得到的混合物Q与上述盐酸完全反应,释放出H2的物质的量为 。
17ZH2+12W,得到的混合物Q(17ZH2+12W)在6.0 mol·L-1 HCl溶液中能完全释放出H2。1 mol Z17W12完全吸氢后得到的混合物Q与上述盐酸完全反应,释放出H2的物质的量为 。
(1)第三周期ⅢA族 Mg>Al>N>O
(2)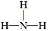 H∶
H∶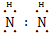 ∶H 离子键
∶H 离子键
(3)33 H3AsO4 NH3>PH3>AsH3
(4)2Fe3++Cu 2Fe2++Cu2+ KSCN溶液 溶液呈红色
2Fe2++Cu2+ KSCN溶液 溶液呈红色
(5)52 mol
【解析】蛋白质主要含有C、H、O、N等元素,由化合价可知X为N;Y为O、Z为Mg、W为Al、R为Fe;(2)氮原子最外层有5个电子,每个氢原子形成3个共价键,所以N2H4的结构式为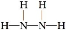 ,然后依据结构式写出电子式;MgO属于离子化合物;(3)As位于第四周期,比上一周期同族元素的原子序数大18,由H3PO4可知As的最高价氧化物对应的水化物的化学式为H3AsO4;1 mol Mg17Al12完全吸氢后得到的混合物Q中含有17 mol MgH2、12 mol Al,与盐酸完全反应后分别生成34 mol H2、18 mol H2
,然后依据结构式写出电子式;MgO属于离子化合物;(3)As位于第四周期,比上一周期同族元素的原子序数大18,由H3PO4可知As的最高价氧化物对应的水化物的化学式为H3AsO4;1 mol Mg17Al12完全吸氢后得到的混合物Q中含有17 mol MgH2、12 mol Al,与盐酸完全反应后分别生成34 mol H2、18 mol H2


科目:高中化学 来源:2013-2014学年高考化学二轮冲刺非选择题增分专练 图像、图表练习卷(解析版) 题型:实验题
酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法,其中溶液的pH变化是判断滴定终点的依据。

(1)为了准确绘制上图,在滴定开始时和________,滴液速度可以稍快一点,测试和记录pH的间隔可大些;当接近________时,滴液速度应该慢一些,尽量每滴一滴就测试一次。
(2)在图中A的pH范围使用的指示剂是____________;C的pH范围使用的指示剂是________________;D区域为________________。
(3)用0.1 032 mol·L-1的盐酸溶液滴定未知浓度的氢氧化钠溶液,重复三次的实验数据如下表所示:
实验序号 | 消耗0.1 032 mol·L-1的盐酸溶液的体积/mL | 待测氢氧化钠溶液的体积/mL |
1 | 28.84 | 25.00 |
2 | 27.83 | 25.00 |
3 | 27.85 | 25.00 |
则待测氢氧化钠的物质的量浓度是________mol·L-1。在上述滴定过程中,若滴定前滴定管下端尖嘴中有气泡,滴定后气泡消失,则测定结果将________(填“偏高”、“偏低”或“不影响”)。
(4)下列关于上述中和滴定过程中的操作正确的是________(填字母)。
A.用碱式滴定管量取未知浓度的烧碱溶液
B.滴定管和锥形瓶都必须用待盛放液润洗
C.滴定中始终注视锥形瓶中溶液颜色变化
D.锥形瓶中的待测液可用量简量取
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题复习 离子反应、氧化还原反应练习卷(解析版) 题型:选择题
下列所述事实与化学(或离子)方程式不相符的是( )
A.能说明氧化性H2O2>Fe3+:2Fe2++H2O2+2H+ 2Fe3++2H2O
2Fe3++2H2O
B.能说明NH3结合H+能力比H2O强:NH3+H3O+ N
N +H2O
+H2O
C.能说明盐酸是强酸:2HCl+CaCO3 CaCl2+CO2↑+H2O
CaCl2+CO2↑+H2O
D.能说明CH3COOH是弱电解质:CH3COO-+H2O CH3COOH+OH-
CH3COOH+OH-
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题复习 电化学练习卷(解析版) 题型:填空题
工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。某科研小组用该原理处理污水,设计装置示意图如图所示。

(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时应向污水中加入适量的 。
a.H2SO4 b.CH3CH2OH c.Na2SO4
d.NaOH e.BaSO4
(2)电解池阳极实际发生了两个电极反应,其中一个反应生成一种无色气体,则阳极的电极反应式分别是Ⅰ. ;Ⅱ. 。
(3)该燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料作电极。为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(见上图)。A物质的化学式是 。
(4)已知燃料电池中有1.6 g CH4参加反应,则C电极理论上生成气体 L(标准状况)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题复习 电化学练习卷(解析版) 题型:选择题
一种太阳能电池的工作原理如图所示,电解质为铁氰化钾K3[Fe(CN)6]和亚铁氰化钾K4[Fe(CN)6]的混合溶液。下列说法中不正确的是( )

A.K+移向催化剂b
B.催化剂a表面发生的化学反应:Fe(CN -e-
-e- Fe(CN
Fe(CN
C.Fe(CN 在催化剂b表面被氧化
在催化剂b表面被氧化
D.电解质溶液中的Fe(CN 和Fe(CN
和Fe(CN 浓度基本保持不变
浓度基本保持不变
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题复习 物质结构和元素周期律练习卷(解析版) 题型:选择题
元素的原子结构决定其性质和在周期表中的位置,下列说法中正确的是( )
A.元素周期表中位于金属和非金属分界线附近的元素属于过渡元素
B.某微粒的结构示意简图为 ,则该元素在周期表中位于第三周期、ⅥA族
,则该元素在周期表中位于第三周期、ⅥA族
C.过氧化氢电子式:
D Pd和
Pd和 Pd互为同位素
Pd互为同位素
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题复习 物质结构与性质(选修3)练习卷(解析版) 题型:填空题
太阳能电池的发展已经进入了第三代。第三代就是铜铟镓硒CIGS等化合物薄膜太阳能电池以及薄膜Si系太阳能电池。完成下列填空:
(1)亚铜离子(Cu+)基态时的电子排布式为 。
(2)硒为第4周期元素,相邻的元素有砷和溴,则3种元素的第一电离能从大到小顺序为 (用元素符号表示),用原子结构观点加以解释 。
(3)与镓元素处于同一主族的硼元素具有缺电子性(价电子数少于价层轨道数),其化合物可与具有孤对电子的分子或离子生成加合物,如BF3能与NH3反应生成BF3·NH3。BF3·NH3中B原子的杂化轨道类型为 ,B与N之间形成 键。

(4)单晶硅的结构与金刚石相似,若将金刚石晶体中一半的C原子换成Si原子且同种原子不成键,则得上图所示的金刚砂(SiC)结构;在SiC中,每个C原子周围最近的C原子数目为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com