
下列所述事实与化学(或离子)方程式不相符的是( )
A.能说明氧化性H2O2>Fe3+:2Fe2++H2O2+2H+ 2Fe3++2H2O
2Fe3++2H2O
B.能说明NH3结合H+能力比H2O强:NH3+H3O+ N
N +H2O
+H2O
C.能说明盐酸是强酸:2HCl+CaCO3 CaCl2+CO2↑+H2O
CaCl2+CO2↑+H2O
D.能说明CH3COOH是弱电解质:CH3COO-+H2O CH3COOH+OH-
CH3COOH+OH-
科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题10常见非金属元素及其重要化合物练习卷(解析版) 题型:选择题
下列与实验相关的叙述正确的是( )。
A.稀释浓硫酸时,应将蒸馏水沿玻璃棒缓慢注入浓硫酸中
B.将SO2和Cl2按等物质的量比通入品红溶液中,品红很快褪色
C.NO2与H2O反应的过程中,被氧化的氮原子与被还原的氮原子的个数比为2∶1
D.检验某溶液是否含有SO42—时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮冲刺选择题限时提速专练 定量分析练习卷(解析版) 题型:选择题
某铅酸蓄电池的工作原理如图所示,其总反应式为Pb+PbO2+2H2SO4=2PbSO4+2H2O。下列判断不正确的是( )
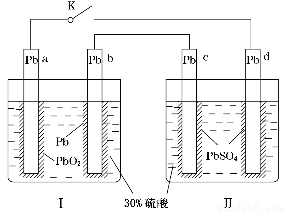
A.闭合K时,d电极的反应式为PbSO4+2H2O-2e-=PbO2+4H++SO42—
B.当电路中转移0.2 mol电子时,Ⅰ中消耗的H2SO4为0.2 mol
C.闭合K时,Ⅱ中SO42—向c电极迁移
D.闭合K一段时间后,Ⅱ可单独作为原电池,d电极为正极
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题复习物质的组成分类及能量变化练习卷(解析版) 题型:选择题
下列有关化学实验的描述中正确的是( )
A.将40 g NaOH溶于1 L蒸馏水中,该溶液的物质的量浓度为1 mol·L-1
B.配制一定物质的量浓度的NaCl溶液,如果NaCl固体中含有Na2CO3,所配制溶液中c(Na+)将偏低
C.将2.5 g CuSO4·5H2O溶解在97.5 g水中,配制质量分数为2.5%的CuSO4溶液
D.把200 mL 3 mol·L-1的BaCl2溶液跟100 mL 3 mol·L-1的KCl溶液混合后,溶液中c(Cl-)=5 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题复习 离子反应、氧化还原反应练习卷(解析版) 题型:填空题
亚硝酸(HNO2)是一种与醋酸酸性相当的弱酸,很不稳定,通常在室温下立即分解。
(1)写出亚硝酸的电离方程式: 。
(2)在酸性条件下,当NaNO2与KI按物质的量之比1∶1恰好完全反应,且I-被氧化为I2时,产物中含氮的物质为 (填化学式)。
(3)要得到稳定的HNO2溶液,可以向冷冻的NaNO2浓溶液中加入或通入某种物质,下列物质不适合的是 (填字母)。
a.稀硫酸 b.二氧化碳 c.二氧化硫 d.磷酸
(4)碱性工业废水中的N 可用铝粉除去。已知此反应体系中含有Al、NaAlO2、NaNO2、NaOH、NH3·H2O、H2O六种物质。
可用铝粉除去。已知此反应体系中含有Al、NaAlO2、NaNO2、NaOH、NH3·H2O、H2O六种物质。
①写出上述反应的离子方程式: 。
②发生上述反应后废水的pH将 (填“增大”“减小”或“不变”)。
(5)酸性工业废水中的N 可用尿素除去。尿素
可用尿素除去。尿素
( )与N
)与N 在酸性条件下反应生成两种无毒气体。该反应中生成16.8 L(已折算为标准状况)混合气体时,消耗尿素的质量为 g。
在酸性条件下反应生成两种无毒气体。该反应中生成16.8 L(已折算为标准状况)混合气体时,消耗尿素的质量为 g。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题复习 电解质溶液与电离平衡练习卷(解析版) 题型:填空题
Ⅰ.已知:H2A的A2-可表示S2-、S 、S
、S 、Si
、Si 或C
或C 等离子。
等离子。
(1)常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1 NaOH溶液。有关微粒物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。请根据图示填空:

①当V(NaOH)=20 mL时,溶液中离子浓度大小关系: 。
②等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水 (填“大”“小”或“相等”),欲使NaHA溶液呈中性,可以向其中加入 。
(2)若H2A为硫酸:t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数KW= 。
Ⅱ.已知:在25 ℃时 H2O H++OH- KW=10-14
H++OH- KW=10-14
CH3COOH H++CH3COO- Ka=1.8×10-5
H++CH3COO- Ka=1.8×10-5
(3)醋酸钠水解的平衡常数Kh的表达式为 ,具体数值= ,当升高温度时,Kh将 (填“增大”“减小”或“不变”)。
(4)0.5 mol·L-1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)为a;1 mol·L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为 ,a与b的关系为 。(填“大于”“小于”或“等于”)
Ⅲ.(5)25 ℃时,将a mol·L-1的氨水与b mol·L-1盐酸等体积混合,反应后溶液恰好显中性,则a b(填“大于”“小于”或“等于”)。用a、b表示NH3·H2O的电离平衡常数为 。
b(填“大于”“小于”或“等于”)。用a、b表示NH3·H2O的电离平衡常数为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题复习 电解质溶液与电离平衡练习卷(解析版) 题型:选择题
工业上常用还原沉淀法处理含铬废水(Cr2 和Cr
和Cr ),其流程为:Cr
),其流程为:Cr
 Cr2
Cr2
 Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓
已知:
(1)步骤①中存在平衡:2Cr (黄色)+2H+
(黄色)+2H+ Cr2
Cr2 (橙色)+H2O
(橙色)+H2O
(2)步骤③生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s) Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)
(3)常温下,Cr(OH)3的溶度积Ksp=10-32;且当溶液中离子浓度小于10-5 mol·L-1时可视作该离子不存在
下列有关说法中正确的是( )
A.步骤①中加酸,将溶液的pH调节至2,溶液显黄色,Cr 浓度增大
浓度增大
B.步骤①中当2v(Cr )=v(Cr2
)=v(Cr2 )时,说明反应2Cr
)时,说明反应2Cr (黄色)+2H+
(黄色)+2H+ Cr2
Cr2 (橙色)+H2O达到平衡状态
(橙色)+H2O达到平衡状态
C.步骤②中,若要还原1 mol Cr2 ,需要12 mol (NH4)2Fe(SO4)2·6H2O
,需要12 mol (NH4)2Fe(SO4)2·6H2O
D.步骤③中,当将溶液的pH调节至6时,则可认为废水中的铬已除尽
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题复习 物质结构和元素周期律练习卷(解析版) 题型:填空题
X、Y、Z、W、R是元素周期表前四周期中的常见元素,其相关信息如下表:
元素 | 相关信息 |
X | 组成蛋白质的基础元素,其最高正化合价与最低负化合价的代数和为2 |
Y | 地壳中含量最高的元素 |
Z | 存在质量数为23,中子数为11的核素 |
W | 生活中大量使用其合金制品,工业上可用电解熔融氧化物的方法制备其单质 |
R | 有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
(1)W在元素周期表中的位置为 ;X、Y、Z、W四种元素的原子半径从大到小的顺序是 (用元素符号表示)。
(2)X与氢两元素按原子数目比1∶3和2∶4构成分子A和B,A的结构式为 ;B的电子式为 。化合物ZY中存在的化学键类型为 。
(3)砷(As)是人体必需的微量元素,与X同一主族,As原子比X原子多两个电子层,则砷的原子序数为 ,其最高价氧化物对应的水化物的化学式为 。该族二、三、四周期元素的气态氢化物的稳定性从大到小的顺序是 (用化学式表示)。
(4)用RCl3溶液腐蚀铜线路板的离子方程式为 。检验溶液中R3+常用的试剂是 ,可以观察到的现象是 。
(5)Z W合金(Z17W12)是一种潜在的贮氢材料,由Z、W单质在一定条件下熔炼而成。该合金在一定条件下完全吸氢的反应方程式为:Z17W12+17H2
W合金(Z17W12)是一种潜在的贮氢材料,由Z、W单质在一定条件下熔炼而成。该合金在一定条件下完全吸氢的反应方程式为:Z17W12+17H2 17ZH2+12W,得到的混合物Q(17ZH2+12W)在6.0 mol·L-1 HCl溶液中能完全释放出H2。1 mol Z17W12完全吸氢后得到的混合物Q与上述盐酸完全反应,释放出H2的物质的量为 。
17ZH2+12W,得到的混合物Q(17ZH2+12W)在6.0 mol·L-1 HCl溶液中能完全释放出H2。1 mol Z17W12完全吸氢后得到的混合物Q与上述盐酸完全反应,释放出H2的物质的量为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com