
| A. | 在加入铝粉能产生H2的溶液中:NH4+、Fe2+、SO42-、NO3- | |
| B. | 无色碱性溶液中:Na+、K+、MnO4-、CO32- | |
| C. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中:NH4+、Al3+、NO3-、Cl- | |
| D. | c(ClO-)=1.0 mol•L-1的溶液:Na+、SO32-、S2-、SO42- |
分析 A.在加入铝粉能产生H2的溶液中存在大量氢离子或氢氧根离子,亚铁离子、铵根离子与氢氧根离子反应,硝酸根离子在酸性条件下能够氧化亚铁离子,且酸性条件下硝酸根离子具有强氧化性,与铝反应不会生成氢气;
B.无色溶液中不会存在有色离子,高锰酸根离子为有色离子;
C.该溶液为酸性溶液,四种离子之间不反应,都不与氢离子反应;
D.次氯酸根离子具有强氧化性,能够氧化硫离子、亚硫酸根离子.
解答 解:A.在加入铝粉能产生H2的溶液为酸性或强碱性溶液,NH4+、Fe2+与碱性溶液中的氢氧根离子反应,NO3-在酸性条件下具有强氧化性,能够氧化亚铁离子,且与铝反应不会生成氢气,故A错误;
B.MnO4-为有色离子,不满足溶液无色的条件,故B错误;
C.该溶液为酸性溶液中,溶液中存在大量氢离子,NH4+、Al3+、NO3-、Cl-之间不发生反应,都不与氢离子反应,在溶液中能够大量共存,故C正确;
D.ClO-能氧化SO32-、S2-,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的正误判断,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 只有金属单质才有焰色反应 | B. | 只有金属化合物才有焰色反应 | ||
| C. | 某些金属或其化合物都有焰色反应 | D. | 只有金属离子才有焰色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
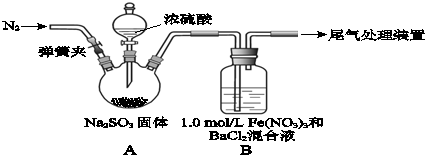
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液和CO2的反应 | B. | NaOH溶液和醋酸的反应 | ||
| C. | NaOH溶液和盐酸反应 | D. | 氨水和稀H2SO4的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烧碱溶液 | B. | 饱和碳酸氢钠溶液 | ||
| C. | 饱和碳酸钠溶液 | D. | 饱和氯化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaO+H2O═Ca(OH)2 | B. | 2Na2O2+2H2O═4NaOH+O2↑ | ||
| C. | C+H2O═CO+H2 | D. | Cl2+H2O═HCl+HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下33.6LH2 | B. | 所含电子的物质的量为4mol的H | ||
| C. | 20℃.45gH2O | D. | 常温下,16gO2,与14gN2的混合气体 | ||
| E. | 含原子总数约为1.204×1024的NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,NaClO溶液可用Cl2与NaOH溶液反应获得,写出该反应的离子方程式Cl2+2OH-=Cl-+ClO-+H2O
,NaClO溶液可用Cl2与NaOH溶液反应获得,写出该反应的离子方程式Cl2+2OH-=Cl-+ClO-+H2O查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com