
分析 (1)①MnO2+H2O2+2H+=Mn2++O2↑+2H2O中,Mn元素的化合价降低,过氧化氢中O元素的化合价升高;
②Mn2++H2O2=MnO2+2H+中,Mn元素的化合价升高,O元素的化合价降低,以此来解答;
(2)由H2O2→O2知,双氧水在反应中作还原剂,所以还必须有氧化剂参加反应,在反应中得电子化合价降低,根据化合价知,高锰酸根离子作氧化剂,还原产物是锰离子,同时反应后生成水,
①反应的化学方程式为:2KMnO4+5H2O2+3H2SO4═K2SO4+2MnSO4+5O2↑+8H20;
②反应中氧化剂是 KMnO4;被氧化元素是氧元素;若有0.5mol H2O2参加此反应,电子转移个数为0.5×2NA;
(3)H2O2为二元弱酸分步电离;如是酸碱中和,可在褪色后再加入碱,观察溶液是否变红;
(4)过氧化氢具有氧化性而漂白性,过氧化氢是极性分子,正负电荷中心不重合.
解答 解:(1)①MnO2+H2O2+2H+=Mn2++O2↑+2H2O中,Mn元素的化合价降低,过氧化氢中O元素的化合价升高;
②Mn2++H2O2=MnO2+2H+中,Mn元素的化合价升高,O元素的化合价降低,
A.H2O2在①中是还原剂,在②中是氧化剂,故A错误;
B.Mn2+在①中是还原产物,在②中是还原剂,故B错误;
C.由元素的化合价升降可知,在①中每生成1 molO2,转移1mol×2×(1-0)=2mo电子l,转移的电子数为1.204×1024,故C错误;
D.反应①+②可得2H2O2=2H2O+O2↑,在二氧化锰催化作用下,1 mol H2O2分解生成0.5molO2,故D正确;
故选D;(2)由H2O2→O2知,双氧水在反应中作还原剂,所以还必须有氧化剂参加反应,在反应中得电子化合价降低,根据化合价知,高锰酸根离子作氧化剂,还原产物是锰离子,同时反应后生成水,
①反应的化学方程式为:2KMnO4+5H2O2+3H2SO4═K2SO4+2MnSO4+5O2↑+8H20,故答案为:2KMnO4+5H2O2+3H2SO4═K2SO4+2MnSO4+5O2↑+8H20;
②反应中氧化剂是 KMnO4;被氧化元素是氧元素;若有0.5mol H2O2参加此反应,电子转移个数为0.5×2NA,故答案为:KMnO4;氧元素;NA;
(3)H2O2为二元弱酸,其酸性比碳酸弱,水溶液中分步电离,电离方程式为:H2O2?HO2-+H+,HO2-?H++O22-,如是酸碱中和,可在褪色后再加入碱,观察溶液是否变红,若变红,则第一同学的观点正确;若未出现红色,则另一同学的观点正确,故答案为:H2O2?HO2-+H+,HO2-?H++O22-;在褪色后的溶液中,加入适量的NaOH溶液,若又出现红色,则第一同学的观点正确;若未出现红色,则另一同学的观点正确;
(4)过氧化氢具有氧化性而漂白性,过氧化氢是极性分子,正负电荷中心不重合,故答案为:氧化性;不对称.
点评 本题考查氧化还原反应,明确反应中元素的化合价升降是解答的关键,侧重基本概念和转移电子数的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 溶液中c(OH-)和c(H+)都减小 | B. | 溶液的PH增大 | ||
| C. | 醋酸电离平衡向左移动 | D. | 溶液中c(H+)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01mol•L-1 | B. | 0.04mol•L-1 | C. | 0.08mol•L-1 | D. | 0.16mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族族数 周期序数 | ||||||||
| ⑤ | ⑥ | ⑧ | ||||||
| ① | ③ | ④ | ⑦ | ⑩ | ||||
| ② | ⑨ |
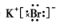 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
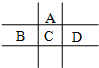 有A、B、C、D、E五种短周期元素,已知A、B、C、D四种元素在周期表中的位置如图所示,其中C元素的最高价氧化物对应的水化物浓溶液是一种常见的干燥剂.D在海水中大量富集.E的氧化物是两性氧化物,回答下列问题:
有A、B、C、D、E五种短周期元素,已知A、B、C、D四种元素在周期表中的位置如图所示,其中C元素的最高价氧化物对应的水化物浓溶液是一种常见的干燥剂.D在海水中大量富集.E的氧化物是两性氧化物,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.6g金属钠变成Na+,失去的电子数为0.2NA | |
| B. | 1.0L 1mol/L NaOH水溶液中含有的氧原子数为NA | |
| C. | 17g NH3所含的电子数为10NA | |
| D. | 9.5g MgCl2 溶于水所得溶液中含Cl-数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
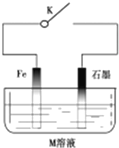
| A. | 常温下,断开K时,若M溶液为浓硫酸,则铁发生化学腐蚀 | |
| B. | 关闭K,若M为氯化钠,则铁极的电极反应式为O2+4e-+2H2O=4OH- | |
| C. | 关闭K,若M为硫酸铵,则石墨极的电极反应式为2H++2e-=H2↑ | |
| D. | 关闭K,若M溶液为海水,石墨换成铜或银,则叫外加电流的阴极保护法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com