
| A. | 4.6g金属钠变成Na+,失去的电子数为0.2NA | |
| B. | 1.0L 1mol/L NaOH水溶液中含有的氧原子数为NA | |
| C. | 17g NH3所含的电子数为10NA | |
| D. | 9.5g MgCl2 溶于水所得溶液中含Cl-数为0.2NA |
分析 A、求出钠的物质的量,然后根据钠反应后变为+1价来分析;
B、氢氧化钠溶液中,除了氢氧化钠外,水也含氧原子;
C、求出氨气的物质的量,然后根据氨气中含10个电子来分析;
D、求出氯化镁的物质的量,然后根据1mol氯化镁中含2mol氯离子来分析.
解答 解:A、4.6g钠的物质的量为0.2mol,而钠反应后变为+1价,故0.2mol钠反应后失去0.2NA个电子,故A正确;
B、氢氧化钠溶液中,除了氢氧化钠外,水也含氧原子,故溶液中的氧原子的个数多于NA个,故B错误;
C、17g氨气的物质的量为1mol,而氨气中含10个电子,故1mol氨气中含电子为10NA个,故C正确;
D、9.5g氯化镁的物质的量为0.1mol,而1mol氯化镁中含2mol氯离子,故0.1mol氯化镁中含0.2NA个氯离子,故D正确.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 工业制氧、钢铁生锈 | B. | 石蜡熔化、干冰升华 | ||
| C. | 粮食酿酒、烟花燃放 | D. | 汽油挥发、云消雾散 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
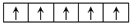 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们的组成都含有C、H、O、N等元素 | |
| B. | 在一定条件下,都能发生水解反应 | |
| C. | 蛋白质和氨基酸一样具有两性 | |
| D. | 淀粉溶液中加稀硫酸加热水解后,加入新制银氨溶液加热可以产生银镜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
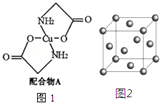 已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到配合物A.其结构如图1所示
已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到配合物A.其结构如图1所示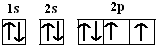 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
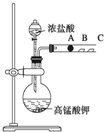 某研究性学习小组设计了一组实验来探究元素周期律.甲同学设计了如图装置来验证卤族元素性质的递变规律.A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.
某研究性学习小组设计了一组实验来探究元素周期律.甲同学设计了如图装置来验证卤族元素性质的递变规律.A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 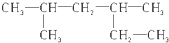 2,4-二甲基己烷 2,4-二甲基己烷 | |
| B. | 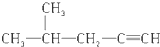 2-甲基-4-戊炔 2-甲基-4-戊炔 | |
| C. | 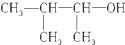 3-甲基-2-丁醇 3-甲基-2-丁醇 | |
| D. | CH3-CHBr-CHBr-CH3 2,3-二溴丁烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com