
| A. | 浓硫酸(98%)的物质的量浓度 | B. | 常温下氯化钠的溶解度 | ||
| C. | 标准状况下气体摩尔体积 | D. | 0.2g金刚石所含的C原子数 |
分析 假设12C的相对原子质量为24,且以0.024 千克12C所含有的原子数为阿伏加德罗常数,则在规定12C的相对原子质量为24时,实际上是把作为相对原子质量的标准从原来用12C质量的$\frac{1}{24}$改为$\frac{1}{24}$,但是单个碳原子的质量并没有因此而发生改变;原来是以0.012kg12C所含有的碳原子数作为阿伏加德罗常数(即6.02×1023),现在用0.024kg12C中所含的原子个数为阿伏加德罗常数(NA),很明显0.024kg12C中所含的原子个数是0.012kg12C中所含的原子个数的2倍;故阿伏加德罗常数(NA)变为原来阿伏加德罗常数的2倍(即2×6.02×1023),以此来解答.
解答 解:A.由假设12C的相对原子质量为24,且以0.024 千克12C所含有的原子数为阿伏加德罗常数,碳原子的质量不变,则阿伏加德罗常数(NA)变为原来阿伏加德罗常数的2倍(即2×6.02×1023),浓硫酸(98%)的物质的量浓度变为原来一半,故A不选;
B.一定温度下,100g水溶解氯化钠的质量为定值,溶解度不变,故B选;
C.气体摩尔体积是单位物质的量的气体所占的体积,阿伏伽德罗常数变大,则物质的量变了,即气体摩尔体积也变化了,故C不选;
D.由假设12C的相对原子质量为24,且以0.024 千克12C所含有的原子数为阿伏加德罗常数,碳原子的质量不变,则阿伏加德罗常数(NA)变为原来阿伏加德罗常数的2倍(即2×6.02×1023),0.2g金刚石所含的C原子数变为原来1半,故D不选;
故选:B.
点评 本题考查阿伏伽德罗常数,明确常数的规定发生变化时其数值的变化是解答本题的关键,并熟悉摩尔质量、摩尔体积等概念来解答.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
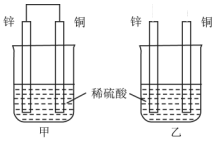 关于如图所示装置的叙述,正确的是( )
关于如图所示装置的叙述,正确的是( )| A. | 两烧杯中铜片表面均无气泡产生 | B. | 甲中铜片是正极,乙中铜片是负极 | ||
| C. | 甲中电流由锌片经导线流向铜片 | D. | 两烧杯锌片均发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
. 和
和 ,写出另3种同分异构体的结构简式
,写出另3种同分异构体的结构简式 、
、 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
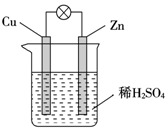
| A. | 电子从铜片经外电路流向锌 | B. | Zn为负极,Cu为正极 | ||
| C. | H+在铜片上得电子发生氧化反应 | D. | 该装置能将电能转化为化学能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com