
分析 (3)②根据碘能使淀粉变蓝色选择试剂;
(4)②橙汁呈酸性,用酸式滴定管取用;
③滴定时左手控制活塞;根据反应的原理,当出现溶液变蓝色且半分钟内不褪色时,维生素C已全部参加了反应;
(5)根据反应原理及题中有关数据,可以计算出橙汁中维生素C的含量;新鲜橙汁中维生素C的含量在500mg/L左右分析判断;
(6)结合c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$,误差分析是标准溶液体积变化引起的测定浓度变化.
解答 解:(3)②利用I2氧化维生素C,根据碘使淀粉显蓝色的性质,应选择淀粉作指示剂,
故答案为:淀粉溶液;
(4)②橙汁呈酸性,用酸式滴定管取用,向锥形瓶中移入20.00mL待测橙汁,滴入2滴指示剂;
故答案为:酸式滴定管或移液管;
③在滴定时左手控制活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化直到滴定终点;根据反应的原理,当出现溶液变蓝色时,维生素C已全部参加了反应,滴定终点现象为:最后一滴标准液滴入,溶液由无色变为蓝色,且半分钟不褪色,
故答案为:活塞,锥形瓶中溶液颜色的变化,最后一滴标准液滴入,溶液由无色变为蓝色,且半分钟不褪色;
(5)15ml标准碘溶液含有碘的质量为:254g/mol×0.015L×7.5×10-3mol•L-1=28.575mg
设20.0mL待测橙汁中维生素C的质量为X
C6H8O6+I2→C6H6O6+2H++2I-
176 254
X 28.575mg
解得:X=19.8mg
则1L中含维生素C的物质的量为:$\frac{19.8×1{0}^{-3}g}{176g/mol}$×$\frac{1L}{0.02L}$=5.625×10-3mol•L-1,所以,则此橙汁中维生素C的浓度是5.625×10-3mol•L-1,纯天然橙汁中维生素C的含量在500mg/L左右,此软包装橙汁不是纯天然橙汁,
故答案为:5.625×10-3mol•L-1;不是;
(6)A.若滴定结束后读数采用仰视测定溶液体积增大,测定结果偏高,故A正确;
B.若锥形瓶用待测橙汁润洗过,待测溶液溶质增大,消耗标准溶液体积增大,测定结果偏高,故B正确;
C.若取标准液的滴定管水洗后未用待装液润洗,消耗标准溶液体积会增大,测定结果会偏高,故C正确;
D.若锥形瓶中含有少量水,对测定结果无影响,故D错误;
故答案为:ABC.
点评 本题考查了橙汁中维生素C的含量,属于综合实验题,完成本题时要注意题中数据的处理,合理进行误差的分析等,本题难度中等.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:选择题
| A. | 12.5% | B. | 14.3% | C. | 48.2% | D. | 87.5% |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 浓硫酸(98%)的物质的量浓度 | B. | 常温下氯化钠的溶解度 | ||
| C. | 标准状况下气体摩尔体积 | D. | 0.2g金刚石所含的C原子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 23 g Na与足量H2O反应完全后可生成NA个H2分子 | |
| B. | 1 mol Cu和足量热浓硫酸反应可生成NA个SO3分子 | |
| C. | 标准状况下,22.4 L Cl2含NA个原子 | |
| D. | 3 mol单质Fe完全转变为Fe3O4,失去8 NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
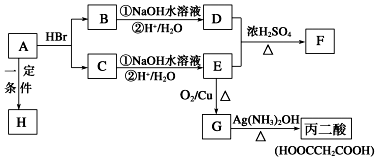 已知A的分子式为C3H4O2,下图是A~H间相互转化的关系图,其中F中含有一个七元环;H是一种高分子化合物.(提示:羟基与双键碳原子相连的醇不存在;同一个碳原子上连有2个或多个羟基的多元醇不存在)
已知A的分子式为C3H4O2,下图是A~H间相互转化的关系图,其中F中含有一个七元环;H是一种高分子化合物.(提示:羟基与双键碳原子相连的醇不存在;同一个碳原子上连有2个或多个羟基的多元醇不存在)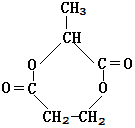
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
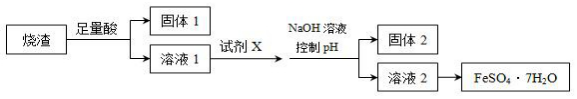
| A. | 溶解烧渣选用足量硫酸,试剂X选用铁粉 | |
| B. | 固体1中一定含有SiO2,控制pH为使Al3+转化为Al(OH)3,进入固体2 | |
| C. | 从溶液2得到FeSO4•7H2O产品的过程中,须控制条件防止其氧化 | |
| D. | 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4•7H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用粮食酿酒经历了淀粉→葡萄糖→乙醇的化学变化过程 | |
| B. | 淀粉、油脂和蛋白质都是高分子化合物 | |
| C. | 煤经过气化和液化等物理变化可转化为清洁燃料 | |
| D. | 聚氯乙烯塑料薄膜可用作食品保鲜膜、一次性食品袋等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.8g铁与0.05mol Cl2充分反应,转移0.1NA电子 | |
| B. | 27g Al与足量NaOH溶液反应生成 33.6L H2 | |
| C. | 1mol由乙烯(C2H4)和乙烷(C2H6)组成的混合物中含有碳原子的数目为2NA | |
| D. | 0.1mol Na2O2与足量二氧化碳反应转移0.1NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6:4:3 | B. | 1:1:1 | C. | 2:3:4 | D. | 3:7:6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com